CT影像组学术前预测乳腺癌腋窝淋巴结转移状况的研究
引言
乳腺癌是临床上最常见的癌症之一,在全球女性相关癌症中死亡率位居第二[1]。腋窝淋巴结转移状况是影响乳腺癌患者预后的重要因素,也是选择外科治疗及术后辅助治疗方案的重要依据[2]。当前确定腋窝淋巴结转移的方法是进行前哨淋巴结活检(Sentinel Lymph Node Biopsy,SLNB),但SLNB 是侵入性的手术,并且可能会引起一些术后并发症[3],因此,术前无创地进行腋窝淋巴结转移预测研究是很有临床价值和意义的。影像组学通过从肿瘤影像中高通量提取影像特征,筛选相关性高的特征进行分析建模,被证明是一种无创有效的肿瘤影像研究方法[4]。本研究尝试通过对112 例乳腺癌患者的术前CT 影像及相关临床病理数据进行研究,探索影像组学在乳腺肿瘤中的研究应用价值。
1 材料与方法
1.1 一般材料
回顾性收集2018 年1 月至2019 年5 月陕西省人民医院的523 例乳腺癌患者CT 影像及临床病理数据,浸润型和非浸润型均包括在内,又经过多次筛选,本研究中共纳入112 例病例,患者均为女性,年龄38~64 周岁,平均年龄55 周岁。纳入标准:① 接受了乳腺癌手术;② 接受了淋巴结活检;③ 在手术切除前七天内接受了我院同一台飞利浦128 层CT 扫描;④ 有完整的多次出入院记录;⑤ 病例中包含明确的TNM 分期。患者的排除标准:① 术后出现各类并发症;② 术前接受过任何治疗;③ 具有家族遗传性癌症史。
数据录入完成后,将所有112 例数据按2:1 的比例随机分配到训练集和测试集中,其中训练集75 例,测试集37 例。
1.2 扫描技术
为了保证获取的材料具有更高的研究质量,选取了来自于飞利浦Brilliance128 层螺旋CT 机的乳腺癌患者影像资料,要求患者扫描时俯卧位,颈胸交界处和腹部垫高,乳房自然悬垂,检查过程中,患者保持平静呼吸,扫描参数为管电压120 kV,管电流200~300 mA,螺距Pitch=1,准值0.75 mm,层距0.9 mm,层厚0.9 mm,512×512 矩阵,窗位-30~30 HU,窗宽350~500 HU。
1.3 图像分割
图像分割采用了基于影像灰度的半自动阈值分割法,使用3D Slicer 软件进行操作。在本研究中邀请两位具有多年乳腺肿瘤影像诊断工作经验的放射科医生对乳腺CT 影像进行感兴趣区域(Region of Interest,ROI)分割,分割前两位医生对研究材料中每个病例的病理结果均不了解,两位医生分别对同一患者数据进行分割处理,分割完成后由一位具有15 年以上乳腺肿瘤影像诊断工作经验的放射科主任医生对每一位病例影像二选一筛选最佳分割影像,从而保证分割结果准确性。图像分割完成后,为了最大限度消除图像噪声并降低计算复杂度,对分割后的图像进行了量化处理。入组的某个病例影像的分割过程及量化结果如
1.4 影像组学特征提取
本研究使用Matlab R2016b 软件从ROI 中提取影像特征共计156 个,分别为基于一阶灰度值特征21 个、基于七个不变矩的特征7 个、基于二维形态特征4 个、基于二维图像的灰度共生矩阵特征(0,45°,90°,135°)92 个、基于二维小波变换特征(近似分量、水平细节分量、垂直细节分量、对角细节分量)32 个。
1.5 影像组学特征选择
本研究采用R 语言的glmnet 包建立Lasso 模型来选择特征,将所有提取的影像组学特征和腋窝淋巴结转移结果作为特征选择的输入量,其中影像特征作为自变量X,腋窝淋巴结转移状态作为因变量Y,构建Lasso 模型选择特征,选择特征过程中用Bootstrapping 算法来降低估计偏差。

图1 乳腺肿瘤CT影像分割处理过程
注:a. CT 源图像;b. CT 肿瘤分割图像;c. 肿瘤区域图像;d. 肿瘤区域量化图像。
1.6 建立影像组学标签
根据所选择的影像特征及通过特征选择算法获得的相应特征系数,为每个患者构建影像组学特征标签。计算得到每个患者对应的影像组学特征标签值特征标签值,并绘制相应的直方图,特征标签值计算方法如公式(1)所示。

公式中featurei 代表选择出的影像组学特征值,coefficien ti 代表每个影像组学特征在glmnet 包选择特征时所对应的系数值,它表示对应的影像组学特征与乳腺癌腋窝淋巴结转移的相关性权重值,Compensation coefficient代表Lasso 选择完特征时留下的补偿系数[5]。
1.7 影像组学模型建立
本研究采用R 语言建立Logistics 回归模型,将特征标签值以及临床因素患者的年龄、TNM 肿瘤分期作为建立多变量Logistics 回归预测模型的输入,将CT 病例报告中的腋窝淋巴结转移结果作为Logistics 回归预测模型的输出进行关联。
为了更清晰的将特征标签值、年龄(Age)、T 分期这些因素与获取的患者CT 报告的腋窝淋巴结转移结果之间的关联关系表示出来,本文基于多变量逻辑回归模型绘制了影像组学Nomogram,更直观的量化变量关系。
2 结果
2.1 一般材料
入组病例统计信息如表1 所示。
2.2 特征选择
通过特征提取从CT 影像中提取的156 个特征,用Lasso 算法进行特征选择,特征选择过程如图2 所示,最终得到9 个影像组学特征,结果如表2 所示。
2.3 构建特征标签
75 名训练集病例患者相对应特征标签值值计算结果如表3 所示,利用患者编号做x 轴,特征标签值值做y 轴绘制有关特征标签值直方图,直观表示每个患者特征标签值值如图3 所示。
表1 入组病例统计
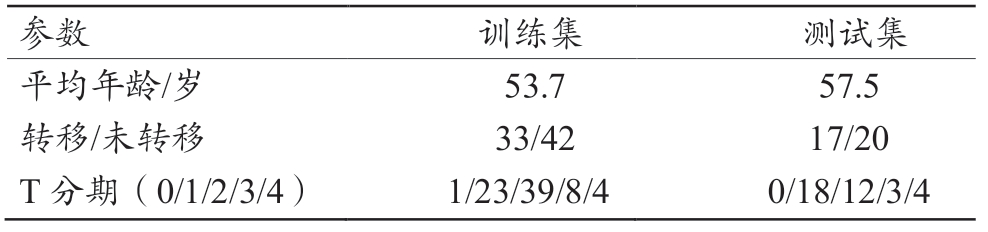
参数 训练集 测试集平均年龄/岁 53.7 57.5转移/未转移 33/42 17/20 T 分期(0/1/2/3/4) 1/23/39/8/4 0/18/12/3/4

图2 Lasso算法筛选影像组学参数过程
注:a. Lasso 特征选择过程的特征系数收敛图,不同颜色的曲线代表了不同自变量的变化,随着参数log(λ)增大,无关系数的变量逐渐趋向于0;b. 采用10 倍交叉验证选取最优λ,本研究取左边第1 条垂直虚线对应的参数值。
表2 特征选择结果
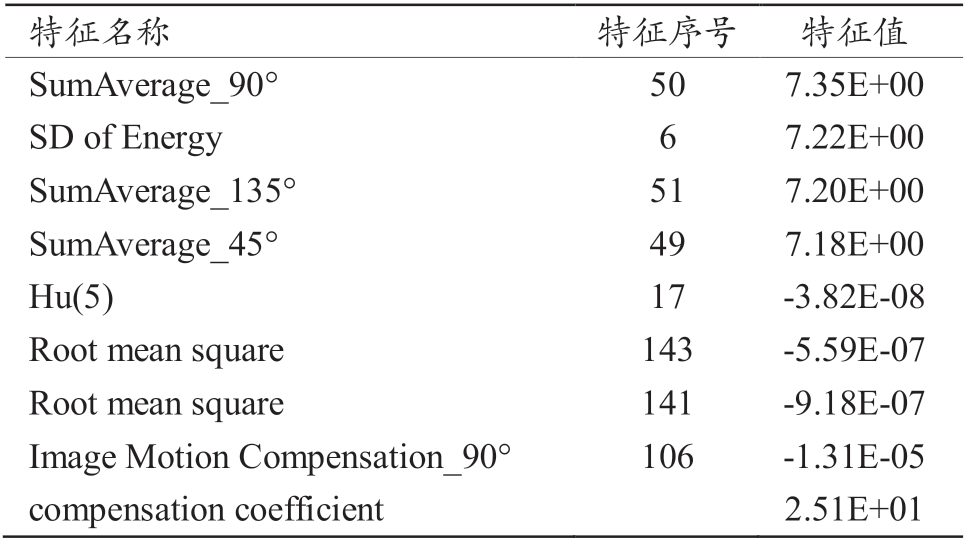
特征名称 特征序号 特征值SumAverage_90° 50 7.35E+00 SD of Energy 6 7.22E+00 SumAverage_135° 51 7.20E+00 SumAverage_45° 49 7.18E+00 Hu(5) 17 -3.82E-08 Root mean square 143 -5.59E-07 Root mean square 141 -9.18E-07 Image Motion Compensation_90° 106 -1.31E-05 compensation coefficient 2.51E+01

图3 训练集特征标签直方图
2.4 模型建立及性能评价
最终本文使用训练集数据,选定T 分期与患者年龄、特征标签值特征标签值、腋窝淋巴结转移情况相关情况下建立逻辑回归模型,开发可用于临床诊断的Nomogram 图(图4),得出相应的C-Index 为0.727(95%CI:0.719~0.736),用测试集数据对训练得到的多变量模型进行验证,得到的C-Index 为0.711(95%CI:0.703~0.718)。
表3 训练集特征标签值
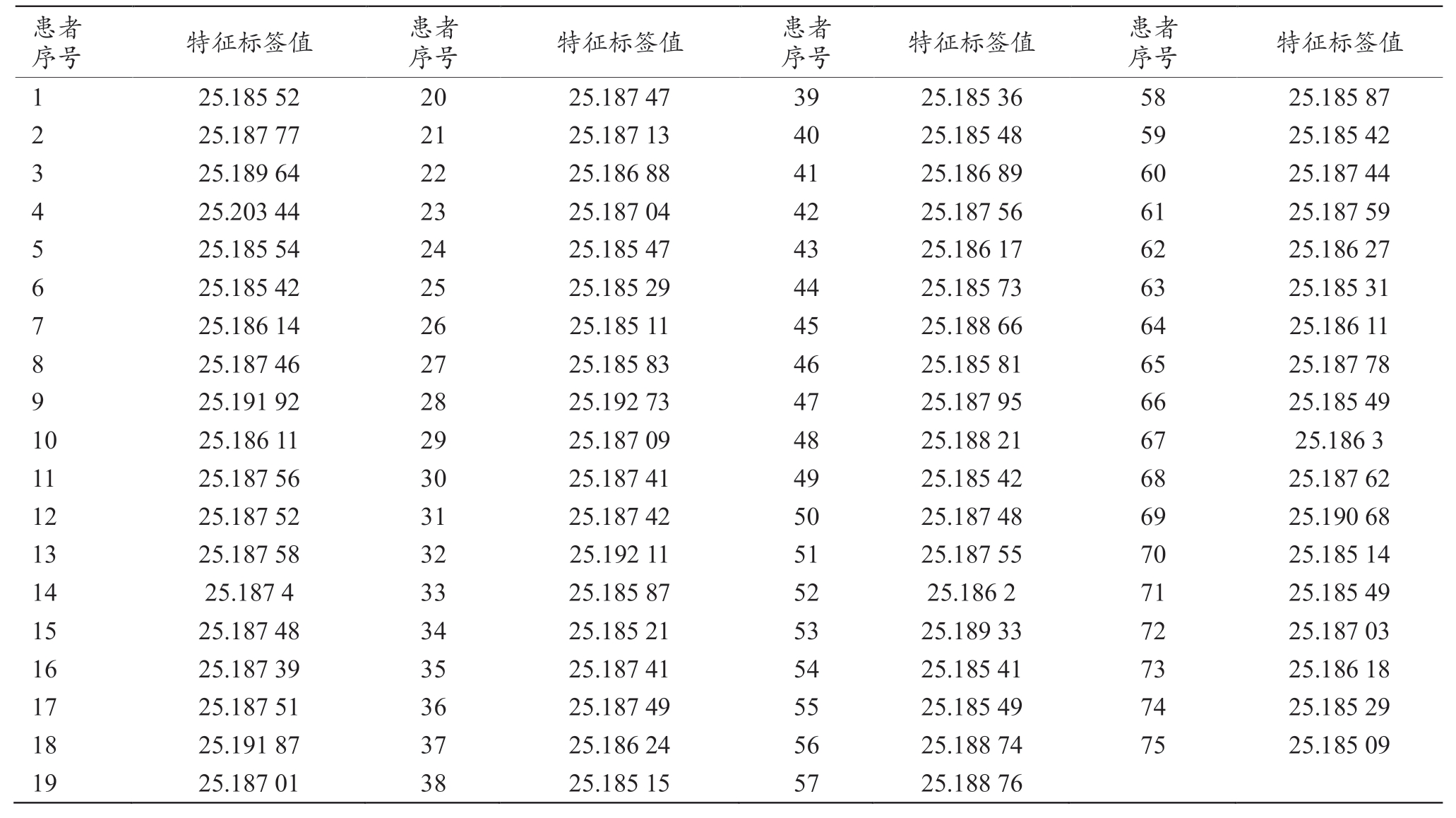
患者患者患者患者序号特征标签值序号特征标签值序号特征标签值序号特征标签值1 25.185 52 20 25.187 47 39 25.185 36 58 25.185 87 59 25.185 42 3 25.189 64 22 25.186 88 2 25.187 77 21 25.187 13 40 25.185 48 60 25.187 44 4 25.203 44 23 25.187 04 41 25.186 89 61 25.187 59 5 25.185 54 24 25.185 47 42 25.187 56 62 25.186 27 6 25.185 42 25 25.185 29 43 25.186 17 63 25.185 31 7 25.186 14 26 25.185 11 44 25.185 73 64 25.186 11 8 25.187 46 27 25.185 83 45 25.188 66 65 25.187 78 9 25.191 92 28 25.192 73 46 25.185 81 66 25.185 49 10 25.186 11 29 25.187 09 47 25.187 95 67 25.186 3 11 25.187 56 30 25.187 41 48 25.188 21 68 25.187 62 12 25.187 52 31 25.187 42 49 25.185 42 69 25.190 68 13 25.187 58 32 25.192 11 50 25.187 48 70 25.185 14 14 25.187 4 33 25.185 87 51 25.187 55 71 25.185 49 15 25.187 48 34 25.185 21 52 25.186 2 72 25.187 03 16 25.187 39 35 25.187 41 53 25.189 33 73 25.186 18 17 25.187 51 36 25.187 49 54 25.185 41 74 25.185 29 18 25.191 87 37 25.186 24 55 25.185 49 75 25.185 09 19 25.187 01 38 25.185 15 56 25.188 74 57 25.188 76
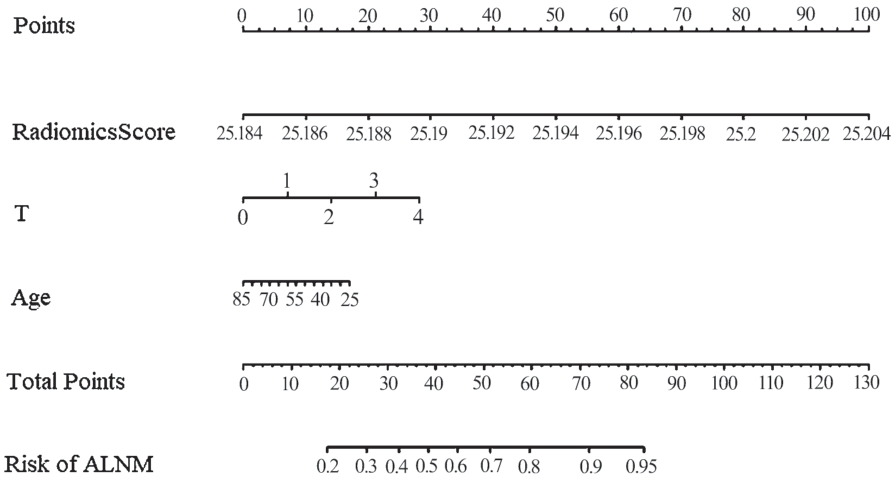
图4 乳腺癌腋窝淋巴结转移预测Nomogram图
注:Points 为分数刻度线,Risk of ALNM(Axillary Lymph Nodes Metastasis,腋窝淋巴结转移)代表腋窝淋巴结转移风险,特征标签值值、T 分期、患者年龄分别对应于Points 有一个相应的分数值,这些分数值相加得到总分数Total Points,再由Total Points 对应找出腋窝淋巴结转移的概率。
根据本文实验中得到的校正曲线(Calibration Curve)如图5 所示,来说明本文所建立的逻辑回归二分类预测模型的性能。由于样本总数比较少,因此本研究在绘制校正曲线时利用所有样本(训练集和测试集总共112 个样本)进行绘制,对训练集数据以及测试集数据在预测模型中的分类结果与每个样本所对应的实际分类结果作比较,利用Nomogram 所得到的样本乳腺癌腋窝淋巴结转移预测概率与样本实际发生腋窝淋巴结转移率分别作为x 轴和y 轴绘制校正曲线。由腋窝淋巴结转移预测概率和腋窝淋巴结实际转移概率计算得到预测模型的均方误差为0.072,并且由图可看出Apparent Curve 与Bias-corrected Curve 高度拟合,与此同时,它们分别与Ideal Curve 具有较好的拟合度,该预测模型在术前无创预测乳腺癌患者腋窝淋巴结转移情况具有一定效能。
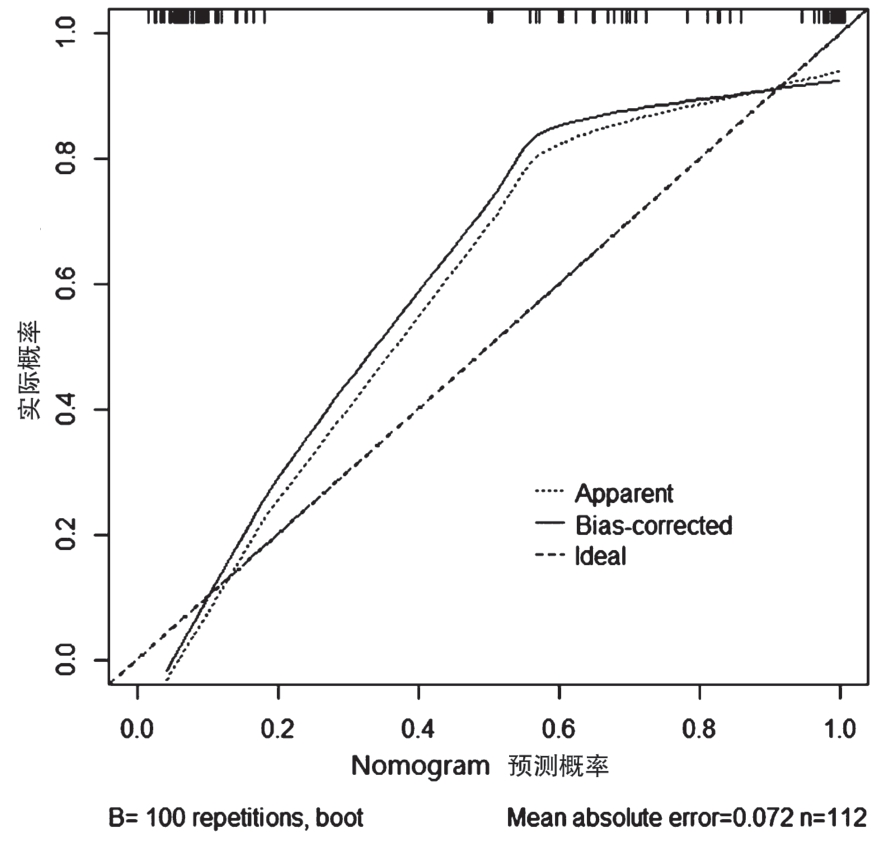
图5 预测模型校正曲线
3 讨论
乳腺癌患者的腋窝淋巴结转移状态对患者的预后和治疗有重要影响[6]。如果腋窝淋巴结没有发生转移,原则上不需要进行腋窝淋巴结清扫(Axillary Lymph Nodes Dissection,ALND)手术,若发生转移,则需要执行ALND[7]。目前可以通过SLNB 来判断腋窝淋巴结有没有发生转移[8]。虽然SLNB 的侵袭性要远远小于ALND 手术,但作为一种侵入性手术,仍然会给患者身体带来一定伤害[9]。因此,开发高准确性、无创的方法对腋窝淋巴结转移状况进行预测具有重要的意义。
近年来兴起的影像组学能够更准确地反映肿瘤的异质特征和生物学特性,为精准医学的开展提供了新的思路[10-11]。本研究尝试采用影像组学方法对腋窝淋巴结转移情况进行术前无创预测,通过从112 例乳腺癌患者CT 影像资料中提取肿瘤的156 个影像组学特征,用Lasso 算法对这些特征进行筛选,最终选定9 个相关性最高的特征建立影像组学标签,选定T 分期、患者年龄、腋窝淋巴结转移情况等临床相关危险因素与影像特征标签值特征标签值一起建立影像组学Logistic Regression 模型,开发腋窝淋巴结转移Nomogram 图,得出相应的C-Index 为0.727(95%CI:0.719~0.736),用测试集数据对模型进行验证,得到的C-Index 为0.711(95%CI:0.703~0.718)。最后绘制校正曲线对模型性能进行评价,计算得到预测模型的均方误差为0.072,评价结果显示模型性能较好,影像组学方法对预测乳腺癌腋窝淋巴结转移状况具有一定效能。
影像组学在乳腺癌的研究方面,2013 年,Noemí 等[12]通过研究发现乳腺癌患者的前哨淋巴结分子特征可以有效预测肿瘤向其他腋窝淋巴结的转移;2016 年,Li 等[13]通过对美国国家癌症研究所多机构TCGA/TCIA 的91 例经活检证实的侵袭性乳腺癌进行了影像组学分析,证实利用MRI 图像的肿瘤表型可以预测侵袭性乳腺癌的分子分类;2017 年,Dong 等[14]通过研究T 加权脂肪抑制(T-FS)和扩散加权成像(Diffusion Weighted Imaging,DWI)MRI 的影像组学特征,进行了乳腺癌前哨淋巴结转移的预测,性能良好;2018 年,Ma 等[15]通过对诊断为侵袭性乳腺癌患者的53 例低Ki67 表达(Ki67 增殖指数小于14%)和324 例高Ki67 表达(Ki67 增殖指数大于14%)进行对比分析发现,从DCE-MRI 中提取的乳腺肿瘤影像组学特征与乳腺癌Ki67 表达高度相关。影像组学的发展和逐步成熟为乳腺癌的精准治疗提供了新的研究思路和有效手段[16]。
本研究的创新性在于采用了影像组学的方法,对乳腺癌患者腋窝淋巴结转移状况进行术前的无创预测。影像组学方法具有稳定性和可重复性的特点[17-19]。但是本研究仍有很多不足之处,需要通过进一步的研究进行完善。首先,入组的病例数量不够丰富,可能会导致模型成熟度不高;其次,本研究入组的病例均来自同一家医院,模型未得到充分的训练和验证,后期还需要进行多中心研究来评估此方法的临床应用价值。本研究采用了回顾性的研究方法,后续我们可以考虑采用回顾性和前瞻性研究相结合的方法,以进一步提高模型的泛化能力。
综上所述,本研究基于乳腺癌患者术前CT 影像的影像组学特征及相应临床病理数据,构建模型对腋窝淋巴结转移状况进行预测,效能评价良好,可以对临床医生治疗决策提供参考。
[1] Freddie B,Jacques F,Isabelle S,et al.Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2018,68:394-424.
[2] Kang YJ,Han W,Park S,et al.Outcome following sentinel lymph node biopsy-guided decisions in breast cancer patients with conversion from positive to negative axillary lymph nodes after neoadjuvant chemotherapy[J].Breast Cancer Res Tr,2017,166:473-480.
[3] Liang Y,Chen XS,Tong YW,et al.Higher axillary lymph node metastasis burden in breast cancer patients with positive preoperative node biopsy: may not be appropriate to receive sentinel lymph node biopsy in the post-ACOSOG Z0011 trial era[J].World J Surg Oncol,2019,17:37.
[4] Valdora F,Houssami N,Rossi F,et al.Rapid review: radiomics and breast cancer[J].Breast Cancer Res Treat,2018,169:217-229.
[5] Colleoni M,Bagnardi V,Rotmensz N,et al.A nomogram based on the expression of Ki-67,steroid hormone receptors status and number of chemotherapy courses to predict pathological complete remission after preoperative chemotherapy for breast cancer[J].Eur J Cancer,2010,46(12):2216-2224.
[6] Lowes S,Leaver A,Cox K,et al.Evolving imaging techniques for staging axillary lymph nodes in breast cancer[J].Clin Radiol,2018,73:396-409.
[7] Collins M,O” Donoghue C,Sun W,et al.Use of axillary lymph node dissection (ALND) in patients with micrometastatic breast cancer[J].J Surg Res,2017,215:55-59.
[8] Bigby M,Zagarella S,Sladden M,et al.Time to reconsider the role of sentinel lymph node biopsy in melanoma[J].J Am Acad Dermatol,2019,80:1168-1171.
[9] Parks RM,Cheung KL.Axillary reverse mapping in N0 patients requiring sentinel lymph node biopsy-A systematic review of the literature and necessity of a randomised study[J].Breast,2017,33:57-70.
[10] 李梦蕾,童彤.影像基因组学在肿瘤研究中的应用进展[J].中国医学计算机成像杂志,2018,24(5):42-45.
[11] 林鹏.基于影像组学的肝细胞癌术前分型和预后评估研究[D].南宁:广西医科大学,2019.
[12] Noemí E,Luis OG,Sara A,et al.Prediction of metastatic breast cancer in non-sentinel lymph nodes based on metalloprotease-1 expression by the sentinel lymph node[J].Eur J Cancer,2013,49(5):1009-1017.
[13] Li H,Zhu YT,Burnside ES,et al.Quantitative MRI radiomics in the prediction of molecular classifications of breast cancer subtypes in the TCGA/TCIA data set[J].NPJ Breast Cancer,2016,2:16012.
[14] Dong YH,Feng QJ,Yang W,et al.Preoperative prediction of sentinel lymph node metastasis in breast cancer based on radiomics of T2-weighted fat-suppression and diffusionweighted MRI[J].Eur Radiol,2018,28:582-591.
[15] Ma W,Ji Y,Qi L,et al.Breast cancer Ki67 expression prediction by DCE-MRI radiomics features[J].Clin Radiol,2018,73:909.e1-e5.
[16] 黄海林,邹林颖,何远翔,等.乳腺癌的治疗进展[J].中国医药,2006,1(5):317-319.
[17] Choe J,Lee SM,Do KH,et al.基于深度学习的CT重建核图像转换可增强肺结节或肿块的影像组学可重复性[J].国际医学放射学杂志,2019,(5).
[18] 栗伟,于鲲,冯朝路,等.一种基于影像组学的肿瘤分型方法:中国,CN108765411A[P].2018-11-06.
[19] 白龙,李光俊,张月美,等.影像组学在脑肿瘤精准诊疗中的应用和挑战[J].中华放射肿瘤学杂志,2018,(5):522-526.
Study on CT Radiomics for the Preoperative Prediction of Axillary Lymph Node Metastasis in Breast Cancer