互联网思维在可吸收缝合线类短期植入物医疗器械不良事件重点监测中的探索应用
引言
随着现代医学的快速发展,外科手术技术日益提高,外科医学[1-2]对缝线的张力、可操作性和可吸收性等多方面的要求也不断增多,外科缝线从天然材料向合成聚合材料方向快速发展。自20 世纪50 年代至今,诸多外科学和合成材料领域等相关专业的学者、专家共同协作,创造出许多适应各种不同临床需要的外科手术人工合成缝线。相继问世的有尼龙线、聚酯线、聚丙烯线等人工合成的不可吸收缝线[3],以及以聚乙醇酸、聚乳酸羟基乙酸[4](又称乙交酯和丙交酯共聚纤维)、聚对二氧环己酮[5-6]等为主的多种人工合成的可吸收缝合线[7-8]。为了进一步改进缝线性能,2003 年美国亦推出了含三氯生抗菌剂的可吸收缝合线。近年来还推出了无需打结的倒刺缝线[9],更好地满足临床需求。
1 医疗器械产品不良事件监测概述
2002 年我国首次提出医疗器械上市后监测[《关于开展医疗器械不良事件监测试点工作的通知》(国药监械[2002]400 号)][10],涉及国内四家试点医疗机构及相关医院,涉及聚丙烯酰胺水凝胶、角膜塑形镜、心血管内支架、心脏瓣膜四个监测品种。
2012 年1 月20 日,国务院发布《国务院关于印发国家药品安全“十二五”规划的通知》(国发[2012]5 号)[11],同时由国家食药总局开始在全国范围内选取100 个高风险医疗器械品种开展医疗器械上市后首次重点监测。通过开展重点监测,制订高风险医疗器械产品上市后监测技术规范,完成上市后重点监测产品的安全风险分析报告。2016年,国家食药总局再次选取100 个高风险医疗器械产品开展国家“十三五”重点品种监测。“十二五”和“十三五”期间,我省共承担了12 个重点产品的监测项目;2016—2017 年期间,我省还承担了两个浙江省药监局的省级重点产品监测项目(肠内营养泵和导尿管类产品)。笔者在这三个期间分别承担了眼用透明质酸钠凝胶、导尿管和可吸收缝合线三个重点监测项目。
2018 年8 月13 日,国家市场监管总局和国家卫健委联合签发的国家市监总局令第1 号《医疗器械不良事件监测和再评价管理办法》[12]正式发布,明确提出了医疗器械上市后重点监测的定义,即其为研究某一品种或者产品上市后风险情况、特征、严重程度、发生率等,主动开展的阶段性监测活动。该新办法的发布使得医疗器械重点监测有了正式的法律地位。
2 可吸收缝合线类短期植入物产品不良事件监测模式的探索
2.1 目前国内医疗器械上市后监测模式现状
从我国开始开展对医疗器械产品上市后监测工作以来,无论是日常不良事件监测,还是国家组织的重点监测,医疗器械产品可疑不良事件基本上都是在产品使用阶段(即产品使用的术前和术中阶段)发生、发现、收集和上报的。实际上,医疗器械产品使用后阶段分为产品使用术后滞留在使用单位和术后离开使用单位两个阶段,其中在产品使用术后滞留在使用单位阶段,不良事件监测同产品使用阶段,即易发现、收集和上报;而若患者术后离开使用单位阶段发生了不良事件,监测手段尚未有报道,不良事件也往往难以收集获取,从而使得该阶段不良事件监测可能成为短期植入类产品上市后不良事件监测最长时间的空白盲区,因该阶段产品使用后的风险数据理论上可主要由患者反馈获取,故又称患者反馈信息(或患者反馈)。而该空白盲区监测阶段发生的不良事件风险同样可能与医疗器械产品因素、产品使用操作因素、产品使用完毕后其他相关因素(包括患者个体自身、患者离开医疗机构后的生活环境、患者术后手术部位医疗介入的响应度、术后手术部位恢复大小环境等)相关,正是由于该空白盲区监测阶段可能持续时间较长,产品使用风险的监测重要性就更显突出,而该阶段产品使用后的风险评价自然凸显为更为重要的产品质量和临床安全评估重要价值。
2.2 患者反馈创新监测模式的探索设计
2017 年7 月,为了弥补可吸收缝合线类短期植入医疗器械产品在患者术后离开使用环境后的监测空白阶段的不良事件风险监测,同时也为了能更全面的获取可吸收缝合线类短期植入医疗器械产品使用后的风险状况,基于目前医疗机构不良事件常规监测,我中心首次探索开发建立上市后可吸收缝合线产品在使用一段时间后产品安全有效性在线信息收集模式——PC Web 电脑端(以下简称医院端)和APP 手机移动端(以下简称患者端)相结合的不良事件监测创新模式,该模式的探索创立是通过我中心自主设计和开发的《浙江省医疗器械不良事件重点监测项目在线数据上报及统计分析系统》(以下简称《在线数据系统》)实现的。
《在线数据系统》在患者监测数据信息收集方面设计了患者端和医院端两个来源。其中患者端是本次探索建立的重点,同时考虑到患者因文化水平等多因素的影响,可能导致患者反馈依从性存在相对比较差的状况[13]。故在本次患者监测数据信息收集方面设计上增加了一个医院端备选方案,该方案也是基于和部分医疗机构重点监测点进行了研讨、沟通的基础上增补设计的,即利用这些医疗机构现有的院方反馈中心资源,由该中心通过对使用可吸收缝合线类短期植入医疗器械产品后的患者电话沟通,获取其对使用本品后创口恢复情况的反馈信息。
2.2.1 患者端反馈信息设计
目前,互联网手机软件支持系统中主要有安卓和IOS两类,不管何种支持系统,最终呈现给患者的反馈界面均是一致的,而手机软件支持系统填报界面是通过我中心编制的《国家“十三五”医疗器械产品可吸收缝合线重点监测工作问卷调查》(以下简称《监测问卷调查》)中关联患者手术医院的二维码扫描实现的。
患者端设计的填报信息界面包括患者基本信息项、产品信息项和恢复异常情况反馈项三部分,其中产品信息项作为备选项,该项界面在患者端患者二维码扫描后不会出现,仅在患者反馈创口恢复出现异常情况的前提下,由关联医疗机构填报(主要为该院不良事件归口部门或其内设的回访中心),便于可追溯到相应的可吸收缝合线产品的生产企业、规格型号和批次等信息。
(1)患者基本信息项设计。正常情况下,患者若在某医疗机构使用可吸收缝合线类短期植入医疗器械产品开展手术,则该机构的医院信息系统[14]中应保留有该患者既有的诊疗信息,如患者的住院号(最常见的检索信息,具有唯一可追溯性)、姓名、性别和在医院期间的病程记录等。为了患者/医院回访中心便于填报,同时兼顾到关联医院已有的患者相关信息,若患者有创口恢复异常反馈时,如有必要,可根据关联医院患者住院号可追溯到患者在医院手术期间的所有诊疗信息。故最终对患者基本信息项设计内容包括:患者的住院号、姓名、性别、年龄、手术起始日期、创口恢复情况的反馈日期等,且规定这些列出的信息均属于必填信息,不填写完整,则无法提交反馈信息。
(2)产品信息项设计(仅限于医疗机构填报)。为了能确保产品使用后可能出现可疑不良事件可追溯性,即可达到可追溯到使用产品的具体规格型号和批次等信息,该项设计至少应包含:生产企业名称、产品名称、产品注册证编号、产品规格型号、产品批次信息。
(3)恢复异常情况反馈项设计。为了尽可能包含产品使用后所有的不良事件后果表现信息,建议根据该产品的历史监测数据信息、文献检索、生产企业定期风险评价报告、专家研讨会等获取的产品不良事件后果表现进行规整、分类,可结合产品使用后造成的伤害严重度一并考虑。笔者综合收集到的可吸收缝合线产品上述可疑不良事件来源信息中的表现及伤害严重度[13-21],将其规整如表1 所示。
将患者端出现可疑不良事件后果表现设计为常规可选择项、兜底项、后果表现图片上传/可附文字项目、出现可疑恢复异常时间项、填报时间项共五项内容。其中,第一项是结合表1 规整的结果对创口恢复过程中出现的各类伤害后果列举,在每个列举项前设置有小方框供点击勾选;第二项的设置是针对常规可选择项目可能还存在不足的兜底,设计为“? 其他后果表现有:________。”;第三项是针对患者若有需要,可采用图片上传或者图片上传结合文字的方式反馈恢复情况;第四项的设置是为了统计患者创口从手术之日起至发生创口恢复异常之间的时间,该时间也是衡量产品质量的间接参数;第五项的设置是为了便于对不同监测时间段发生的可疑不良事件进行统计,同时也是为了及时了解监测项目开展的进度。
上述设计中,对患者端患者通过二维码填报的,则无需填写填报日期,点击上报后,系统自动记录上报的当日为填报日期;若是医疗机构反馈中心记录填报内容,则需要将当日回访本例患者信息的日期填写为填报日期。无论是患者端患者主动填报信息,还是患者关联医疗机构反馈中心填报的患者反馈信息,《在线数据系统》设置均可实现下载、打印、返回等选择项。
2.2.2 备选的医院端反馈信息设计
由于该项信息是由医疗机构重点监测点的院方反馈中心通过电话等方式获取患者创口恢复情况的反馈信息,故该项内容在设计上是在患者端基础上减少了二维码扫描方式而来,其他内容与患者端设计一致。
为了充分运用互联网智能优势,我中心在设计医院端反馈信息时增加了产品重点监测期间需要医疗机构重点监测点报告的项目设计内容,具体包括重点监测点基本信息、重点监测点月度监测数据信息、医院端可疑不良事件。《在线数据系统》中医院端设计示意图如图1 所示。与此同时,还要求医疗机构监测点将发现并核实过的可疑不良事件同时通过国家药品不良反应监测信息系统上报。
表1 可吸收缝合线不良事件类别、后果严重度等数据规整汇总
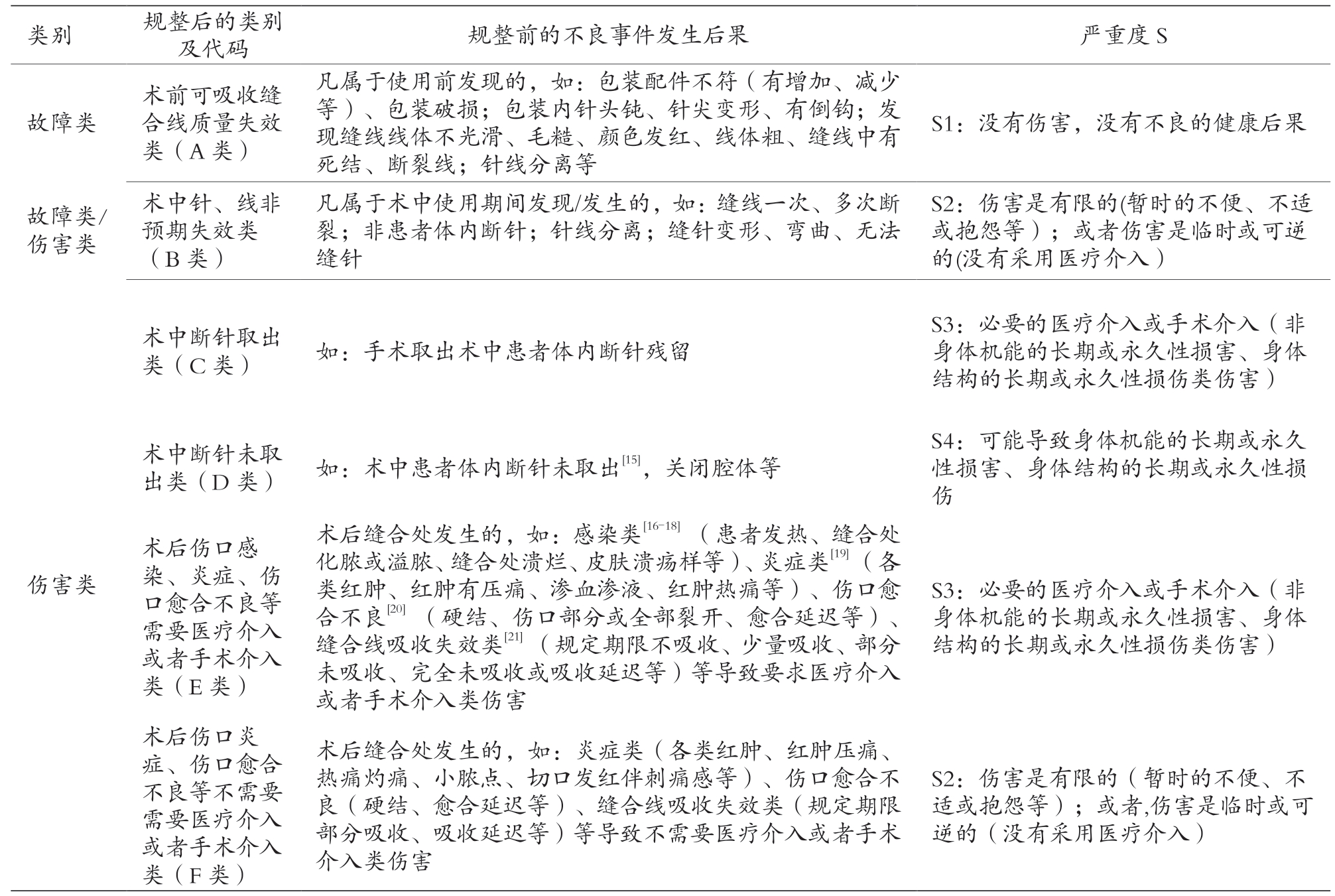
类别 规整后的类别及代码 规整前的不良事件发生后果 严重度S故障类术前可吸收缝合线质量失效类(A 类)凡属于使用前发现的,如:包装配件不符(有增加、减少等)、包装破损;包装内针头钝、针尖变形、有倒钩;发现缝线线体不光滑、毛糙、颜色发红、线体粗、缝线中有死结、断裂线;针线分离等S1:没有伤害,没有不良的健康后果故障类/伤害类术中针、线非预期失效类(B 类)凡属于术中使用期间发现/发生的,如:缝线一次、多次断裂;非患者体内断针;针线分离;缝针变形、弯曲、无法缝针S2:伤害是有限的(暂时的不便、不适或抱怨等);或者伤害是临时或可逆的(没有采用医疗介入)术中断针取出类(C 类) 如:手术取出术中患者体内断针残留S3:必要的医疗介入或手术介入(非身体机能的长期或永久性损害、身体结构的长期或永久性损伤类伤害)伤害类术中断针未取出类(D 类) 如:术中患者体内断针未取出[15],关闭腔体等术后伤口感染、炎症、伤口愈合不良等需要医疗介入或者手术介入类(E 类)术后缝合处发生的,如:感染类[16-18] (患者发热、缝合处化脓或溢脓、缝合处溃烂、皮肤溃疡样等)、炎症类[19] (各类红肿、红肿有压痛、渗血渗液、红肿热痛等)、伤口愈合不良[20] (硬结、伤口部分或全部裂开、愈合延迟等)、缝合线吸收失效类[21] (规定期限不吸收、少量吸收、部分未吸收、完全未吸收或吸收延迟等)等导致要求医疗介入或者手术介入类伤害S4:可能导致身体机能的长期或永久性损害、身体结构的长期或永久性损伤S3:必要的医疗介入或手术介入(非身体机能的长期或永久性损害、身体结构的长期或永久性损伤类伤害)术后伤口炎症、伤口愈合不良等不需要需要医疗介入或者手术介入类(F 类)术后缝合处发生的,如:炎症类(各类红肿、红肿压痛、热痛灼痛、小脓点、切口发红伴刺痛感等)、伤口愈合不良(硬结、愈合延迟等)、缝合线吸收失效类(规定期限部分吸收、吸收延迟等)等导致不需要医疗介入或者手术介入类伤害S2:伤害是有限的(暂时的不便、不适或抱怨等);或者,伤害是临时或可逆的(没有采用医疗介入)
2.2.3 患者反馈信息审核
为了确保患者端和医院端监测到的患者反馈数据的真实、准确和完整性,《在线数据系统》中设计了对这两类反馈信息数据三级审核。第一级由产品使用单位初审,初审数据包括使用单位上报的院内产品使用监测信息、患者端患者上报的监测数据、使用单位反馈中心回访的监测数据,初审重点关注上报监测信息中不良事件内容的专业性;第二级由重点监测点所属辖区的地市中心二级审核,重点关注审核上报监测信息中可疑不良事件内容的完整、真实和准确性;第三级由省中心课题组负责人终审,重点关注审核上报监测信息中可疑严重不良事件。三个层级监测数据的审核可在医疗机构监测点、患者和器械不良事件监测技术机构之间形成一个完整的产品使用后安全有效风险信息的采录、分析评价和管理的闭环监测系统。

图1 《在线数据系统》中医院端设计示意图
3 创新监测模式在可吸收缝合线产品不良事件重点监测中的应用
2018 年6 月至2019 年4 月共11 个月的可吸收缝合线产品重点监测期内,共获取省内14 家该产品医疗机构重点监测点通过《在线数据系统》上报的943652 根使用数量,涉及可疑不良事件19 根(上报率0.002%),对应国内外3家缝合线产品生产企业。
尽管包括浙江大学医学院附属妇产科医院、嘉兴市第二医院、温州市人民医院在内的多家重点监测点医院在患者术后出院时及时安排专人分发带有关联医院二维码的《监测问卷调查》,但最终《在线数据系统》患者端仍未收集到患者反馈数据。而在《在线数据系统》备选医院端共获取反馈总使用数69220 根,反馈占比约7.34%。其中,涉及有可疑不良事件反馈的521 根,涉及国内外缝合线产品生产企业7 家,涉及省内医疗机构重点监测点12 家。
4 结果分析
4.1 创新监测模式的优势
从该创新《在线数据系统》共获取的69220 例可吸收缝合线产品使用术后患者反馈数据来看,该数据是目前我国医疗器械产品上市后日常不良事件监测方式无法实现获取的,即该创新方法解决了原先短期植入物医疗器械不良事件的监测盲区,使得该类医疗器械产品整个生命周期的监测得以完整;同时该《在线数据系统》在数据的收集、归类、统计分析等方面具有及时、便捷、高效的特点。
4.2 创新监测模式的不足
从该创新《在线数据系统》患者端未收集到患者反馈数据来看,患者依从性比较是患者端数据收集的主要因素;另外个别医疗机构重点监测点内部的患者回访中心在对可吸收缝合线类短期植入医疗器械使用后回访的力度和积极性方面可能存在不足。
为了改善这两个环节上的监测数据反馈不足,一方面,建议加强对患者及其家属、医疗机构在医疗器械不良事件监测法律法规方面的宣传和必要的培训;另一方面,建议采取一定方式的举措,提高患者及其家属、医疗机构参与人员对监测工作的依从性和认识,增加其对监测工作反馈的获得感。
5 结论
基于目前患者依从性比较差,在具有患者反馈中心的医疗机构中将互联网思维运用到可吸收缝合线类短期植入物医疗器械不良事件重点监测中是可行有效的。在《医疗器械不良事件监测和再评价管理办法》及相关配套文件陆续发布实施后,医疗器械不良事件监测将会获得更多更强的法律、法规和规章的支持,这样该创新监测方法就完全可以推广到全部植入类医疗器械产品上市后不良事件监测中去,为该类医疗器械产品安全有效使用提供监测保障,为医疗器械监督监管提供更有力的技术支持。
[1] Altman GH,Diaz F,Jakub AC,et al.Silk-based biomaterials[J].Biomaterials,2003,24(3):401-416.
[2] Tajirian AL,Goldberg DJ.A review of sutures and other skin closure materials[J].J Cosmet Laser Ther,2010,12(6):296-302.
[3] Thilagavathi G,Viju S.Silk as a suture material[J].Adν Silk Sci Technol,2015:219-232.
[4] Kimble LD,Bhattacharya D.In vitro degradation effects on strength, stiffness, and creep of PLLA/PBS: a potential stent material[J].In J Polym Mater Po,2015,64(6):299-310.
[5] 王刚,李松,房殿吉.三种缝合线在颌面颈部手术中的应用[J].中国现代医药杂志,2012,14(10):51-53.
[6] 李利发,张井潇,陈小波,等.三种不同缝合线对腹壁手术切口愈合质量影响的研究[J].中国普外基础与临床杂志,2016,23(4):445-449.
[7] Qin DY,Wang WZ.Structure and property for medical suture[J].Technical Textiles,2001,19(10):16-19.
[8] King MW,Gupta BS,Guidoin R.Biotextiles as Medical Implants[M].Philadelphia:Woodhead Publishing Limited,2013:231-273.
[9] 白冰,母健君,雷弋,等.Hem-o-Lok免打结倒刺缝合线在腹腔镜下肾部分切除术中的应用[J].局解手术,2020,29(1):34-37.
[10] 国家食品药品监管局.关于开展医疗器械不良事件监测试点工作的通知[EB/OL].(2002-11-07)[2020-02-02].http://www.nmpa.gov.cn/WS04/CL2196/323262.html.
[11] 国家食品药品监管局.国务院关于印发“十三五”国家食品安全规划和“十三五”国家药品安全规划的通知[EB/OL].(2017-02-21)[2020-02-02].http://www.nmpa.gov.cn/WS04/CL2199/325582.html.
[12] 国家食品药品监管局.《医疗器械不良事件监测和再评价管理办法》(国家市场监督管理总局令第1号)[EB/OL].(2018-08-31)[2020-02-02].http://www.nmpa.gov.cn/WS04/CL2077/330071.html.
[13] Burkhart PV,Sabate E.Adherence to long-term therapies:evidence for action[J].J Nurs Scholarsh,2003,35(3):207.
[14] 王卉.医院信息系统管理研究[J].信息与电脑(理论版),2018,18:195-196.
[15] 杨丽君,王宏,邓剑雄,等.广东省医用缝合线可疑不良事件重点监测分析[J].中国药物警戒,2011,8(12):738-740.
[16] Zucker BE,Simillis C,Tekkis P,et al.Suture choice to reduce occurrence of Surgical site infection, hernia, wound dehiscence and sinus/fistula: a network meta-analysis[J].Ann R Coll Surg Engl,2019,101(3):150-161.
[17] Alawode AO,Adeyemi MO,James O,et al.A comparative study of immediate wound healing complications following cleft lip repair using either absorbable or non-absorbable skin sutures[J].J Korean Assoc Oral Maxillofac Surg,2018,44(4):159-166.
[18] 吕静,徐威.MAUDE数据库中医用缝合线不良事件报告分析[J].中国医疗器械信息,2017,23(1):31-35.
[19] 陈希,龙丽萍.医用缝合线器械不良事件报告分析[J].中国药物警戒,2012,9(2):114-117.
[20] Sayeed B,Hashmi KS,Qamar SA.Wound complications;comparison of non-absorbable suture (prolene) with absorbable suture (vicryl) in terms of wound complications and cosmesis[J].Professional Med J,2019,26(5):753-758.
[21] 王莲莲,李景溪,施展.可吸收缝线材料的可降解与临床应用[J].中国组织工程研究,2015,19(16):2619-2623.
Exploration and Application of Internet Thinking in Key Monitoring of Adverse Events of Medical Devices with Absorbable Suture Short-Term Implants