基于模糊C均值和随机漫步的CT肝脏图像分割算法研究
引言
在计算机辅助手术、治疗计划制定等肝脏相关临床应用中,肝脏区域及肝肿瘤分割是必要的步骤[1]。目前临床上主要采用手工方式勾画肝脏目标区域,耗时且主观差异大。随着分割算法的产生,医学图像分割朝着交互式分割和全自动分割方向发展,其中全自动分割无需人为干预,适用于简单均匀图像分割,对于较复杂和灰度不均图像,分割结果往往不能满足临床需求。交互式结合人工干预与分割算法的优势,显著提高图像分割准确性。
交互式图像分割算法主要利用图像目标像素点与背景像素点的空间位置关系和灰度、边缘等特征信息来完成图像分割[2],主要包含图切理论,分水岭算法,水平集算法和随机漫步算法。其中,随机漫步算法具有分割结果唯一、对模糊边界分割效果显著、对噪声鲁棒性佳等特点,逐步成为应用最广泛的交互式分割算法[3]。但是随机漫步算法分割结果受初始种子点影响较大,为探索更优的分割算法,本研究采用模糊C 均值算法先对图像进行初步分类,分割成相似灰度特征的目标与背景区域,然后采用随机漫步算法提取目标边界,完成图像分割,期望能减少对初始种子点的影响,并有效分割灰度不均和肿瘤边界模糊图像。
1 方法
1.1 图像预处理
图像预处理采用3×3 中值滤波器,不产生新像素灰度,且能保留图像边缘信息。
1.2 标准FCM算法
FCM 算法主要思想是将N 个L 维向量分为C 个模糊组,通过距离测度判断像素灰度属于各类别的隶属程度,不断更新图像像素隶属度和聚类中心,使目标函数达到最小,从而完成像素分类和图像分割[4]。其中像素隶属度是用来描述像素属于某个类别的程度,取值范围为[0,1]。FCM 算法的目标函数和约束条件见公式(1)[5],uij=ui(xj)表示像素灰度xj 属于类别i 的程度,m 是模糊加权系数,常取2,νi={ν1,…,νC}表示i 个聚类中心,dij (xj, νi)=|| xj-νi||2 表示第j 像素灰度到第i 个聚类中心的欧式距离。
采用朗格朗日乘数法求取目标函数最小值,见公式(2),分别对参数λ 和隶属度uij 求导可得隶属度和聚类中心,如公式(3)和(4),直到|u(k+1)-uk|<∈(设定的阈值)停止迭代,完成聚类优化过程。
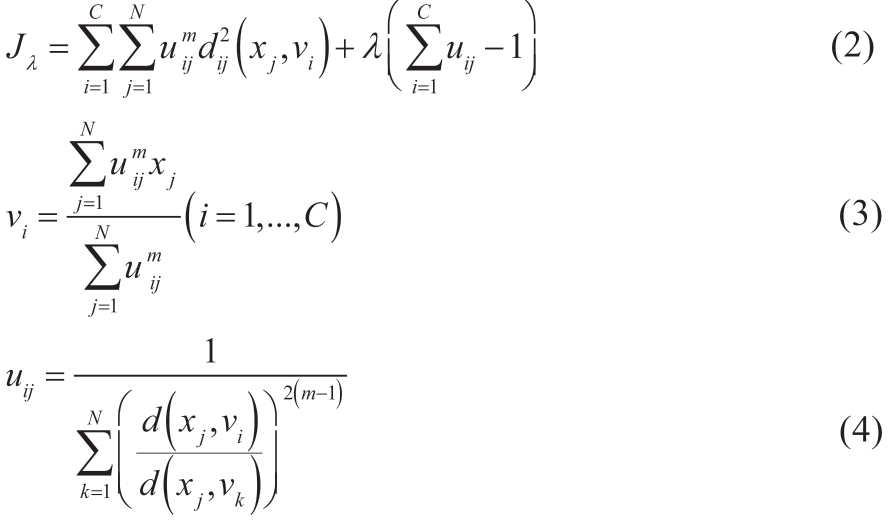
标准FCM 算法对简单图像分割效果显著,但不能分割对比度差、区域重叠和异质性显著的图像。主要由于FCM 算法对初始聚类中心敏感,容易陷入局部最优解。其次,并未关注图像像素空间的联结性与局部特征,受噪声影响显著。本研究先采用标准FCM 算法进行初步分类,然后采用随机漫步算法进一步提升图像分割准确度。
1.3 随机漫步算法
随机漫步算法是一种有监督算法,通过计算从每一个像素点出发的随机漫步者首次到达各类种子点的概率完成像素分类[6]。首先,将图像看作具有固定个数顶点和边组成的离散无向图G=
由电路理论启发,Grady 提出一个随机漫步者首次到达一个种子点的概率等于种子点边界条件下的狄利克雷问题的解[8],狄利克雷问题求解过程如下:首先定义一个拉普拉斯矩阵Lij,当νi=νj 时,Lij=di;当结点νi 与νj 相邻时,Lij=wij;其他情况,Lij=0,其中di=∑wij 称为结点的度,为与结点相邻的所有结点的权值之和。
离散的狄利克雷积分公式见式(6),此时需要将顶点G分成VM(已标记的种子结点)和VN(未标记的种子结点)两个集合,VM 和VN 满足VM∪VN=V,VM∩VN=?,根据结点所属集合不同将拉普拉斯矩阵分解为对角阵,见公式(7)。
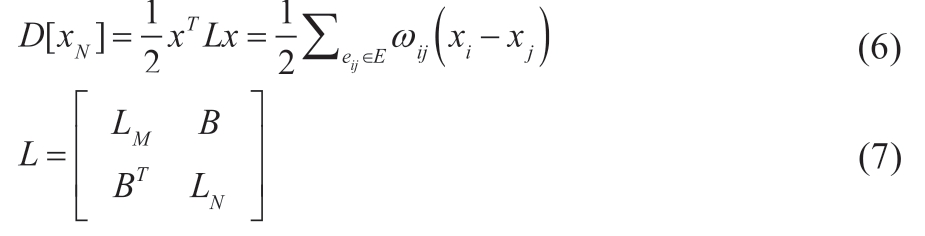
公式(6)根据变换后的拉普拉斯矩阵可改写如下形式,见公式(8)。其中xM 和xN 分别对应种子结点和非种子结点的电势值,即随机漫步算法的概率值。通过对D[xN]求关于xN 的微分可得临界点满足公式(9)。
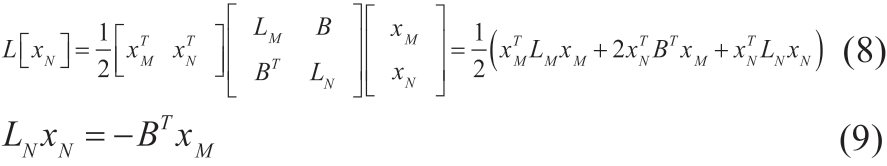
假设结点νi 到标记为s 的种子点的概率为xis,将各种子点的标记集合定义为函数Q(νj )=s,?νj∈VM,其中0<s<k,k 为标记点个数,为在νj∈VM 的点边际s 定义一个|VM |×1 的矩阵,见公式(10)。则狄利克雷问题可转化为求解公式(11),继而可计算所有未标记点i 到标记为s 的种子点的概率xis,且∑xis =1。将各未标记点归并到概率最大值所属标记中实现图像分割,此时的目标函数(12)最小。其中F 表示前景目标区域种子点,B 代表背景种子点,是调和函数的两个边界点,可由人工指定。
1.4 图像分割评价指标
本研究采用定性与定量相结合评估分割图像质量,定性分析采用视觉评估,定量评价指标采用重叠错误率(Overlap Error,OE)[9]、相对误差(Relative Difference,RD)[10]、Dice 相似性系数(Dice Similarity Coefficient,DSC)[11],见公式(13)~(15)。其中A 代表分割所得区域,B 代表真实的分割区域。OE 和RD 越小,DSC 越大,表明图像分割效果越佳。
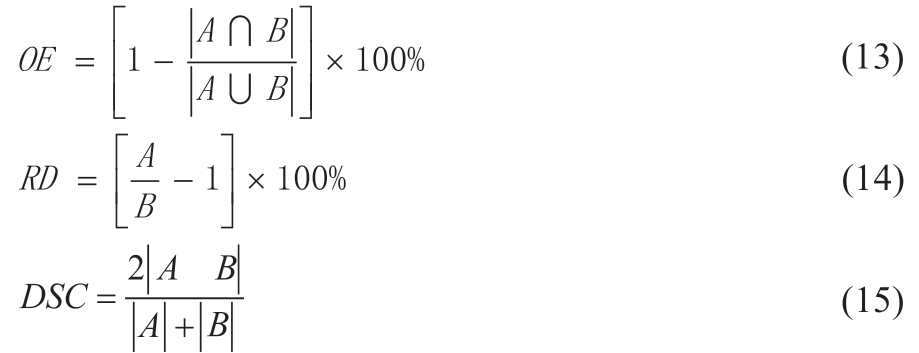
2 方法
将本研究提出算法与文献报道的分割算法进行性能比较。选用3Dircadb 数据库和MIDAS 数据库图像进行仿真实验,纳入大小超过5 mm 的肝肿瘤,排除小于5 mm 的肝肿瘤。所有算法测试均在Matlab 2013a 编程环境下仿真实现。
2.1 本研究提出算法的图像分割
图1 表示不同权值wij 对本研究图像分割结果的影响,可以看出β 变小,wij 变小,目标区域边界逐渐扩大,向真实边界靠近。图2 表示肿瘤图像分割,基于FCM 算法可完成粗布的肿瘤提取,随机漫步算法可进一步精确勾画肿瘤边界,可以看出技师勾画肿瘤边界较大,传统随机漫步算法对灰度不均的肿瘤分割精度显然低于本研究算法,对于肿瘤边界显著图像,分割效果相当。图3 表示不同尺寸肿瘤图像分割结果,可以看出对于相对尺寸较大的肿瘤,本研究算法能精确勾画肿瘤边界,但是对于小尺寸肿瘤,还有待改进。
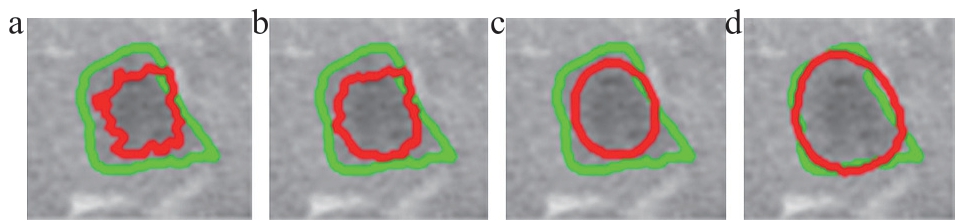
图1 不同权值wij对图像分割结果的影响
注:a. β=100;b. β=10;c. β=1;d. β=0.1。绿线代表技师勾画,红线代表本研究算法。
2.2 不同算法肝脏图像分割结果比较
不同分割算法性能比较结果,见表1。由此可推断本研究分割算法所得评价指标优于其他文献报道算法,可获得更高的分割精度。在对MIDAS 数据库图像(包含10 个肿瘤)分割时,基于本研究算法可获得平均0.81%的DSC、15.61%的OE 和4.02%的RD。同时在对3Dircadb 数据库图像(包含117 个肿瘤)进行分割时,基于本研究算法所得的平均DSC 为0.75%,OE 为22.78%,RD 为8.59%,分割精度较MIDAS 数据库有所下降,主要由于后者包含众多小尺寸肿瘤病灶,影响分割精度。此外发现操作者手工分割与技师分割时均存在过度分割现象,即肿瘤边界大于实际轮廓。
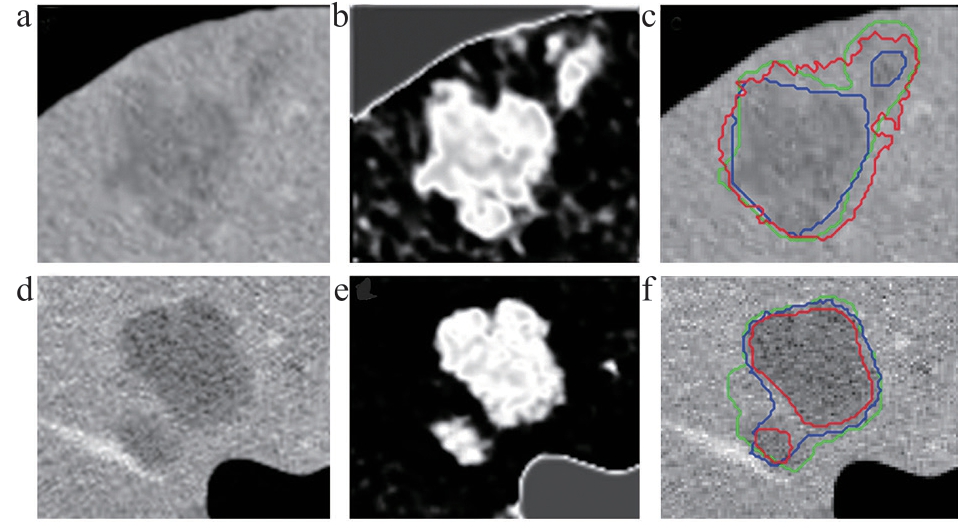
图2 剪切后包含22 mm和7 mm肿瘤的CT肝脏图像
注:a、d. 剪切后包含32 mm 和9 mm 肿瘤的CT 图像;b、e. FCM 算法分割结果;c、f. 技师(绿线)、传统随机漫步(红线)和本研究随机漫步算法(蓝线)图像分割结果。
3 结论
本研究提联合使用FCM 算法和随机漫步算法对CT肝脏图像进行分割,其中FCM 算法可将图像初步划分为不同类的目标区域和背景区域,降低各区域内种子点灰度差异。然后随机漫步算法可快速收敛,完成各像素分类,提取肿瘤边界。仿真实验结果表明,基于本研究提出的CT 肝脏图像分割算法优于多篇文献报道的其他分割算法,能有效分割灰度不均和肿瘤边界模糊图像,是一种可行的图像分割算法。
表1 不同图像分割算法所得结果比较
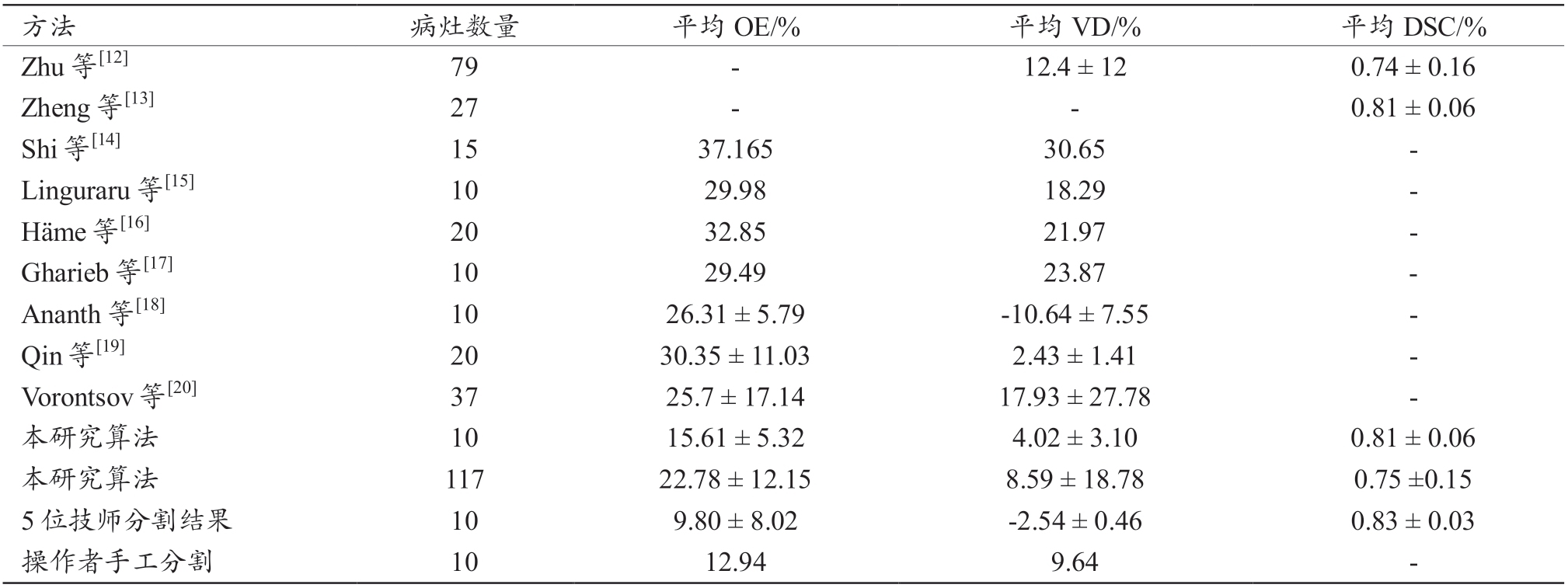
方法 病灶数量 平均OE/% 平均VD/% 平均DSC/%Zhu 等[12] 79 - 12.4 ± 12 0.74 ± 0.16 Zheng 等[13] 27 - - 0.81 ± 0.06 Shi 等[14] 15 37.165 30.65 -Linguraru 等[15] 10 29.98 18.29 -Häme 等[16] 20 32.85 21.97 -Gharieb 等[17] 10 29.49 23.87 -Ananth 等[18] 10 26.31 ± 5.79 -10.64 ± 7.55 -Qin 等[19] 20 30.35 ± 11.03 2.43 ± 1.41 -Vorontsov 等[20] 37 25.7 ± 17.14 17.93 ± 27.78 -本研究算法 10 15.61 ± 5.32 4.02 ± 3.10 0.81 ± 0.06本研究算法 117 22.78 ± 12.15 8.59 ± 18.78 0.75 ±0.15 5 位技师分割结果 10 9.80 ± 8.02 -2.54 ± 0.46 0.83 ± 0.03操作者手工分割 10 12.94 9.64 -
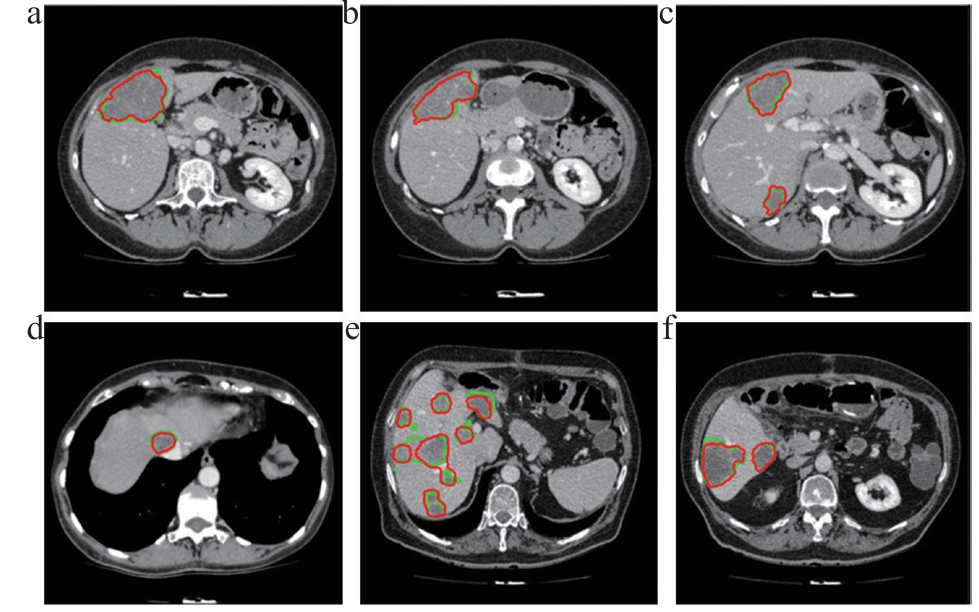
图3 基于本研究算法不同尺寸肝脏肿瘤图像分割结果(红线)与真实分割结果(绿线)比较
注:a. 22 mm; b. 23 mm; c. 9 mm 和4 mm; d. 3mm;e. 2~4 mm ; f. 8 mm和4 mm。
[1] Hong DJ,Zhu M,Zhu ZJ,et al.Clinical and muscle magnetic resonance image findings in patients with late-onset multiple acyl-CoA dehydrogenase deficiency[J].Chin Med J(Engl),2019,132(3):275-284.
[2] Zhou H,Han A,Yang H,et al.Edge gradient feature and longdistance dependency for image semantic segmentation[J].IET Computer Vision,2019,13(1):53-60.
[3] 基于FCM聚类算法与自适应阈值的冠脉钙化分割与量化[J].中国生物医学工程学报,2017,36(5):550-556.
[4] 姜春雨,刘景鑫,钟慧湘,等.基于改进的FCM模糊聚类的颅内出血CT图像分割研究[J].中国医疗设备,2018,33(6):16-20.
[5] 缪正飞,陈广浩,高伟.一种全自动的脑部MR图像分割算法[J].中国医疗设备,2017,32(11):61-65.
[6] 叶伟,陶晶,陈小宇,等.一种新颖的MR脊柱图像自动分割算法研究[J].中国医疗设备,2018,33(9):61-64.
[7] Dong C,Zeng X,Lin L,et al.An Improved random walker with bayes model for volumetric medical image segmentation[J].J Healthc Eng,2017,2017(4):1-11.
[8] Rundo L,Stefano A,Militello C,et al.A fully automatic approach for multimodal PET and MR image segmentation in gamma knife treatment planning[J].Comput Methods Programs Biomed,2017,144(C):77-96.
[9] Casteras JB,Holopainen I,Ripoll JB.On the asymptotic dirichlet problem for the minimal hypersurface equation in a hadamard manifold[J].Pot Anal,2017,47(4):1-17.
[10] Lupa?cu O,St?nciulescu V.Numerical solution for the nonlinear dirichlet problem of a branching process[J].Com Anal Opera Theo,2017,11(8):1-10.
[11] Ma R,Man X.Positive rotationally symmetric solutions for a Dirichlet problem involving the higher mean curvature operator in Minkowski space[J].J Math AnalAppl,2018,460(1):33-46.
[12] Zhu H,Zhuang Z,Zhou J,et al.Improved graph-cut segmentation for ultrasound liver cyst image[J].Mult Tools Appl,2018,77(9):1-19.
[13] Zheng YC,He L,Yang HY,et al.Soft-tissue-segmentation methods during image-guided precision liver surgery[J].Gastroenterol Rep (Oxf),2018,6(3):239-241.
[14] Shi P,Chen J,Lin J,et al.High-throughput fat quantifications of hematoxylin-eosin stained liver histopathological images based on pixel-wise clustering[J].Sci China,2017,60(9):109-120.
[15] Linguraru MG,Richbourg WJ,Liu J,et al.Tumorburden analysis on computed tomography by automated liver and tumor segmentation[J].IEEE Trans Med Imaging,2012,31(10):1965-1976.
[16] Häme Y,Pollari M.Semi-automatic liver tumor segmentation with hidden Markov measure field model and non-parametric distribution estimation[J].Med Image Anal,2012,16(1):140-149.
[17] Gharieb RR,Gendy G,Selim H.A hard c-means clustering algorithm incorporating membership KL divergence and local data information for noisy image segmentation[J].Int J PattRecoArti Intel,2017,32(4):758-769.
[18] Ananth C,Roshni BD,Renuka K,et al.Interactiveautomatic hepatic tumourct image segmentation[J].SSRN Electron J,2014,3(1):2278-9359.
[19] Qin Z,Fan Y,Wan J,et al.An Efficient and Clinical-Oriented 3D liver segmentation method[J].IEEE Acc,2017,5(99):18737-18744.
[20] Vorontsov E,Tang A,Roy D,et al.Metastatic liver tumour segmentation with a neural network-guided 3D deformable model[J].Med Biol Eng Comput,2017,55(1):127-139.
A Hybrid Method Based on Fuzzy C-Means Algorithm and Random Walker Algorithm for CT Liver Image Segmentation