硬式内镜不同清洗流程与检测方法的效能研究
引言
内镜属典型的机体介入性设备,能够对机体各处组织腔内病变进行探查,辅助医师掌握病变点位、特征及性质,辅助影像学、活检诊断,并能够针对部分疾病进行诊疗[1]。研究指出[2],内镜的使用不仅仅可受介入性操作引发机体不良反应,同时长期、重复性应用内镜器械亦为病原体的传播途径。周好杨等[3]调查发现,6.8%~23.5%的医源性感染(Hospital-Acquired Infections,HAI)主因内镜媒介传播感染所致,其中又属硬式内镜造成感染率较高。蔡雪花等[4]报道,硬式内镜因自身器械构成较复杂,常规的清洁、消毒处理措施对这类器械的灭菌清洁难度较高;若清洗方式不科学,或污染物清除不彻底,可为病原菌的定植形成生存环境,将导致极高风险HAI。因此持续优化改进内镜清洗方法,增强清洗效果是确保医疗安全的关键点。《内镜清洗消毒技术操作规范》[5](以下简称《规范》)早已明确了内镜的清洁流程,但当前内镜器械复杂多样,造成《规范》中未能明确内镜分类清洗标准,加之实际工作中因《规范》耗时费力、效率不高等因素导致工作人员在硬式内镜清洗中忽视质量的控制,降低清洗评价标准。为避免上述内镜质控风险的发生,本研究选取手术使用所污染的硬式内镜进行清洗质量改进试验,旨在优化硬式内镜清洗流程,改进质量评价标准。
1 资料与方法
1.1 一般资料
收集我院因手术使用所污染的硬式内镜300套,均为妇科、胸外科、泌尿外科手术所使用的硬式内镜器械,包括腹腔镜190套,输尿管镜28套,肾镜22套,胸腔镜31套,膀胱镜29套。按照数字随机法分组,其中对照组60套(腹腔镜38套,输尿管镜5套,肾镜4套,胸腔镜6套,膀胱镜7套),孔径(7.01±2.34)mm;采取《规范》中标准化“硬式内镜清洗消毒操作规范”流程进行清洗;实验组240套,在标准化“硬式内镜清洗消毒操作规范”流程基础上给予不同改进方法清洗,分为实验A组、实验B组、实验C组、实验D组。其中,实验A组60套器械,包括腹腔镜39套,输尿管镜6套,肾镜5套,胸腔镜5套,膀胱镜5套,孔径(7.62±2.44)mm;实验B组60套器械,包括腹腔镜37套,输尿管镜5套,肾镜5套,胸腔镜7套,膀胱镜6套,孔径(7.51±2.39)mm;实验C组60套器械,包括腹腔镜37套,输尿管镜7套,肾镜4套,胸腔镜6套,膀胱镜6套,孔径(7.28±2.17)mm;实验D组60套器械,包括腹腔镜39套,输尿管镜5套,肾镜4套,胸腔镜7套,膀胱镜5套,孔径(7.32±2.29)mm。各组硬式内镜器械在使用年限、器械类别等资料比较,无统计学差异(P>0.05)。
1.2 纳入与排除标准
纳入标准:① 硬式内镜器械,手术应用频繁,伴有管腔、轴节、齿槽等特征,可拆卸,但清洗难度较大;② 手术患者梅毒抗体(BTR)检测呈(-),丙型肝炎病毒(-),乙肝表面抗原(-),艾滋病毒(-)的手术器械;③ 术后器械伴有明显血渍、污染物。
排除标准:① 硬式内镜破损、伴锈迹;② 器械购买、存储资料丢失;③ 外来硬式内镜。
1.3 方法
术后硬式内镜器械均由消毒供应中心集中回收管理,按照操作章程逐一拆卸至最小件,标识序号、分类。严格遵循《规范》中所明确的硬式内镜清洗消毒流程操作。按照器械类型划分为可浸泡(气腹针、分离钳、抽吸头、Trocar等)与不可浸泡(内窥镜、电子镜头、LIGASURE等)内镜。其清洗流程见表1和表2。
表1 不可浸泡内镜清洗方法

流程 措施 实验组(n=240)对照组(n=60)预处理 器械回收且完成清点,先行通过鲁沃夫多酶清洗液覆盖器械表层。 √初洗 在流动水流下冲洗,清除器械表体污秽物。冲洗时间控制4~6 s为宜。 √ √酶液浸泡5 min鲁沃夫多酶清洗液与水1:150比例,器械浸泡5 min。水温控制25℃~30℃。不可浸泡内镜则鲁沃夫多酶清洗液湿化。√ √酶液擦拭3 min清洁软布浸润鲁沃夫多酶清进行擦拭3 min。 √漂洗 器械于流水漂洗,注意避免细微零件冲刷遗漏或丢失。 √ √终末漂洗 采取蒸馏水或纯水进行最终漂洗。 √ √干燥消毒视硬式内镜器械类型材质合理干燥处理,如塑料材质可温控70℃~75℃;金属材质可调控温度75℃~90℃;不耐热器械则采用低纤维絮状软布轻柔擦拭,无水乙醇(95%)干燥消毒。√ √
1.4 观察指标
严格遵循《内镜清洗消毒技术操作规范》[5]及内镜清洗消毒标准(2009)WS310.1、WS310.2、WS310.3,统计各组硬式内镜清洗合理率;记录各组清洗耗时、计算预估每套硬式内镜清洗成本。
清洗合理率评价标准:① 10倍带光源放大镜检测:10倍视野下观察内镜器械表层是否伴有污渍,若无明显污渍则评价为合格;② 蛋白残留检测:选用残留蛋白检测棒,行Pro-tect测试,根据测试棒变化评定,绿色为阴性(-),浅灰(淡紫色)为弱阳性(+),灰色(紫色)为阳性(++),深灰色(棕紫色)为强阳性(+++),以阴性判定为合格;③ 三磷酸腺苷(Adenosine Triphosphate,ATP)生物荧光测试:选用ATP生物荧光检测仪监测ATP值,ATP值≤150 RLU为合格。
1.5 统计学分析
数据纳入SPSS19.0软件分析,两组独立,正态,方差齐资料组间比较采用t检验;非正态分布的采用非参数秩和检验;多组独立,正态,方差齐资料组间比较采用单方差分析,两两比较采用SNK法;等级资料组间比较采用秩和检验;样本率的比较采用卡方检验或Fisher确切概率法。P<0.05为差异有统计学意义。
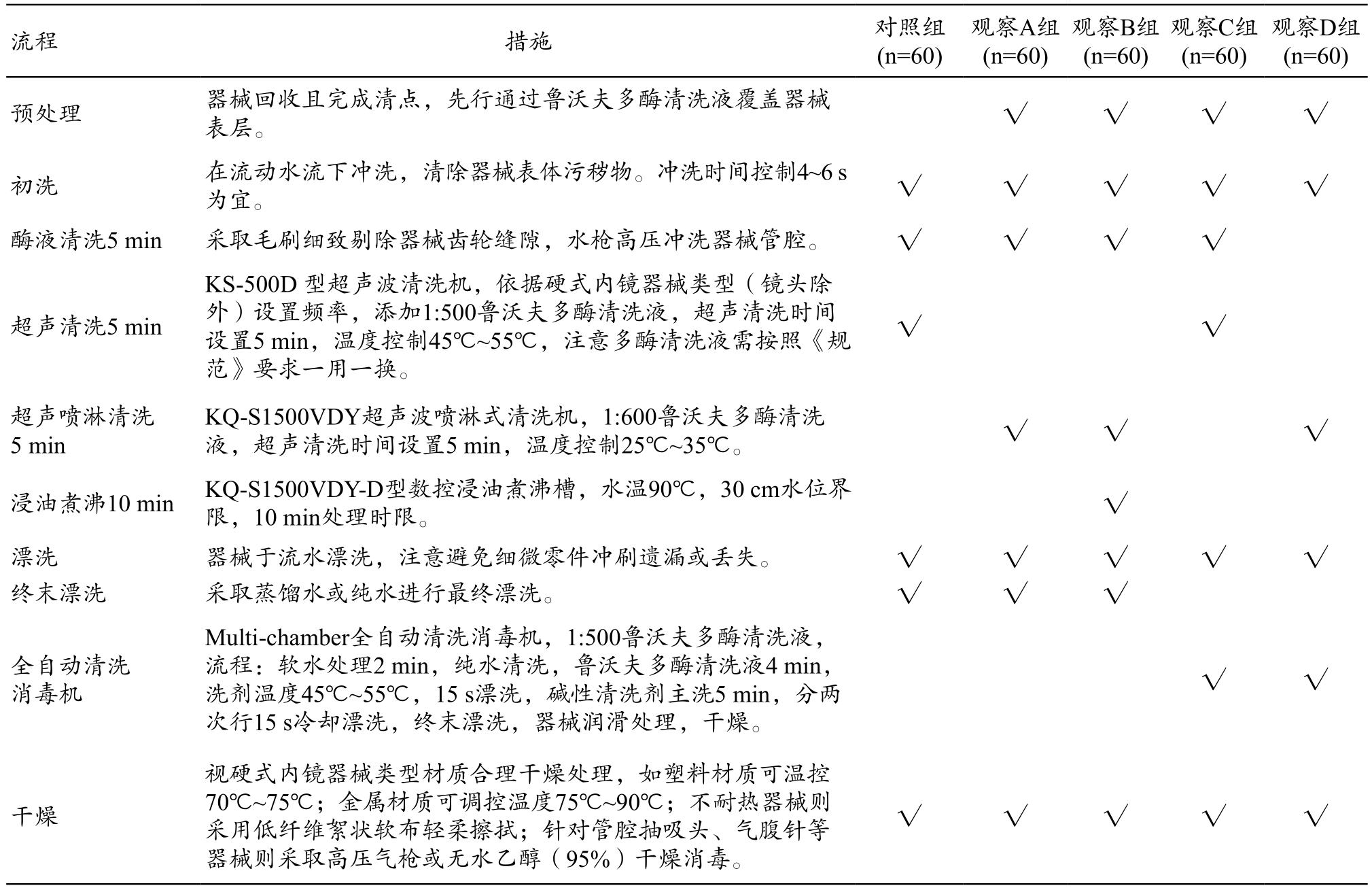
表2 可浸泡内镜清洗方法
注:√表示采取的清洗流程。
流程 措施 对照组(n=60)观察D组(n=60)预处理 器械回收且完成清点,先行通过鲁沃夫多酶清洗液覆盖器械表层。观察A组(n=60)观察B组(n=60)观察C组(n=60)√√√√初洗 在流动水流下冲洗,清除器械表体污秽物。冲洗时间控制4~6 s为宜。√√√√√酶液清洗5 min 采取毛刷细致剔除器械齿轮缝隙,水枪高压冲洗器械管腔。 √ √ √ √超声清洗5 min KS-500D 型超声波清洗机,依据硬式内镜器械类型(镜头除外)设置频率,添加1:500鲁沃夫多酶清洗液,超声清洗时间设置5 min,温度控制45℃~55℃,注意多酶清洗液需按照《规范》要求一用一换。√√超声喷淋清洗5 min KQ-S1500VDY超声波喷淋式清洗机,1:600鲁沃夫多酶清洗液,超声清洗时间设置5 min,温度控制25℃~35℃。 √ √ √浸油煮沸10 min KQ-S1500VDY-D型数控浸油煮沸槽,水温90℃,30 cm水位界限,10 min处理时限。√漂洗 器械于流水漂洗,注意避免细微零件冲刷遗漏或丢失。 √ √ √ √ √终末漂洗 采取蒸馏水或纯水进行最终漂洗。 √ √ √全自动清洗消毒机Multi-chamber全自动清洗消毒机,1:500鲁沃夫多酶清洗液,流程:软水处理2 min,纯水清洗,鲁沃夫多酶清洗液4 min,洗剂温度45℃~55℃,15 s漂洗,碱性清洗剂主洗5 min,分两次行15 s冷却漂洗,终末漂洗,器械润滑处理,干燥。√ √干燥视硬式内镜器械类型材质合理干燥处理,如塑料材质可温控70℃~75℃;金属材质可调控温度75℃~90℃;不耐热器械则采用低纤维絮状软布轻柔擦拭;针对管腔抽吸头、气腹针等器械则采取高压气枪或无水乙醇(95%)干燥消毒。√√√√√
2 结果
2.1 硬式内镜清洗质量
(1)可浸泡硬式内镜器械。10倍带光源放大镜检测发现,实验D组可浸泡内镜清洗质量合格率最高,明显高于实验A组、对照组(P<0.05);蛋白检测棒检测发现,实验D组可浸泡内镜清洗合格率最高,明显高于实验A组、实验B组、对照组(P<0.05),实验C组可浸泡内镜清洗合格率显著高于对照组(P<0.05);ATP生物荧光测试发现,实验D组可浸泡内镜清洗合格率最高,明显高于实验A组、实验B组、对照组(P<0.05),实验C组可浸泡内镜清洗合格率显著高于对照组(P<0.05)。可浸泡内镜清洗质量各组比较结果,见图1。
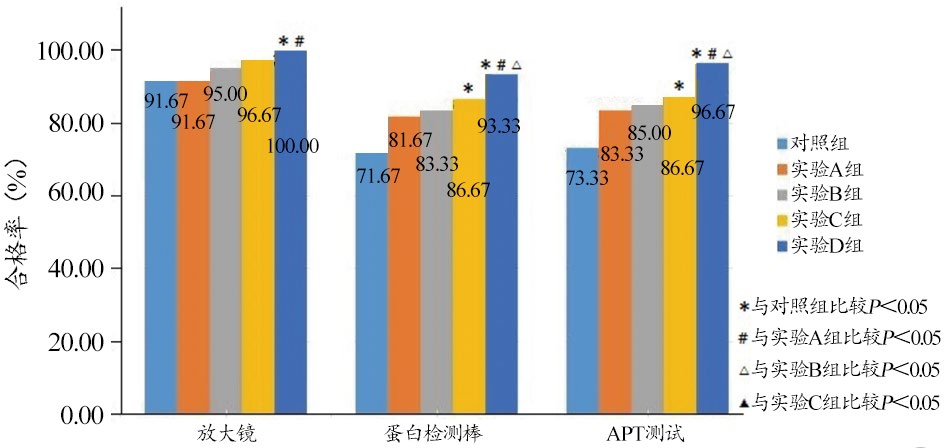
图1 各组可浸泡内镜清洗质量比较
(2)不可浸泡硬式内镜器械。在10倍带光源放大镜检测结果中,两组硬式内镜清洁合格率无统计学差异(P>0.05);在蛋白残留检测与ATP生物荧光测试结果中,实验组不可浸泡硬式内镜清洁质量明显高于对照组(P<0.05)。不可浸泡内镜清洗质量各组比较结果,见图2。
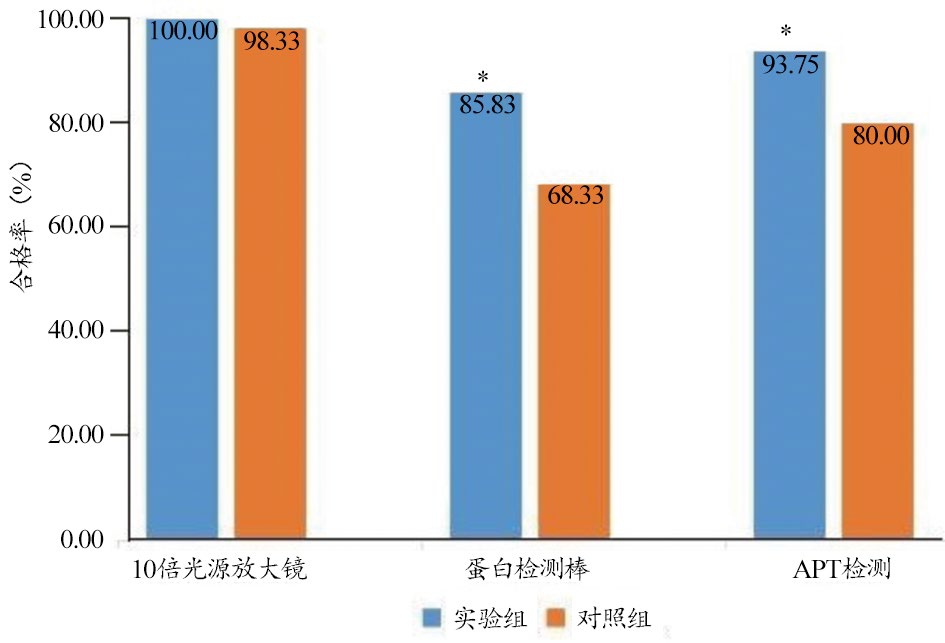
图2 各组不可浸泡内镜清洗质量比较
注:*与对照组比较P<0.05。
2.2 不同检测方法对清洗的硬式内镜检测结果比较
对三种清洗质量评价方式比较,10倍带光源放大镜检测方式与蛋白残留检测、ATP生物荧光测试有明显差异(P<0.05);蛋白残留检测与ATP生物荧光测试无统计学差异(P>0.05);通过一致性检验,Kappa系数达到0.5839,具备一致性。不同检测方法对清洗的硬式内镜检测结果比较,见表3。
表3 不同检测方法对清洗的硬式内镜检测结果比较 [n (%)]

注:P (1)表示10倍带光源放大镜检测与蛋白残留检测比较,P (2)表示10倍带光源放大镜检测与ATP生物荧光测试比较,P (3)表示蛋白残留检测与ATP生物荧光测试比较。
images/BZ_63_236_333_2238_593.pngχ2 (1)P (1)18.356 0.000 χ2 P (2)7.048 0.008 8.451 0.004 χ2 P (3)5.556 0.018 0.105 0.746 3.252 0.071
2.3 两组硬式内镜的清洗时间与成本控制
对照组每套硬式内镜的清洗耗时(42.32±3.85)min,清洗成本18.5元/套;观察A组每套硬式内镜的清洗耗时(60.03±4.12)min,清洗成本20.5元/套;观察B组每套硬式内镜的清洗耗时(60.03±4.12)min,清洗成本20.9元/套;观察C组每套硬式内镜的清洗耗时(60.03±4.12)min,清洗成本22.2元/套;观察D组每套硬式内镜的清洗耗时(60.03±4.12)min,清洗成本23.2元/套。
3 讨论
临床中因硬式内镜造成的HAI时有发生,对公共卫生安全造成巨大影响,因此硬式内镜的清洗质量控制对相关器械使用的病患安全意义非凡。硬式内镜作为高精密特殊医疗器械,因结构过于复杂而造成常规的清洗消毒流程无法有效保证内镜的洁净质量,清洗难度极高[6-7]。目前执行的内镜清洗流程虽能够对内镜器械清洗控制在良好范围内,但现阶段内镜结构越发复杂,《规范》中标准清洗流程已不适应现阶段的硬式内镜实际清洗工作。为确保硬式内镜清洗质量持续提升,本研究结合实际对硬式内镜的清洗流程进行优化,分析更为有效的清洗、评价标准,提升院内医疗卫生控制质量。
在术后及时对硬式内镜做相应的处理可有效破坏病原菌在器械表层的生存环境,降低后续清洗难度[8-9]。内镜器械与干涉血液内氯离子及积液水分子的长期接触可导致腐蚀现象,其中内窥镜、电子镜头、LIGASURE等材质较特殊,不可采取水流持续的冲刷,仅可进行轻柔擦拭处理[10-11]。本研究中针对不可浸泡硬式内镜清洗,发现对手术使用之后的内镜先行多酶原液做器械表层覆盖预处理,利用多酶原液对残留有机物进行全面的分解,形成去污处置的第一个环节;另外多酶原液流动性较低,且水分子量低,在覆盖器械表体之后腐蚀性较少;且先行内镜预处理也为后续清洗提供了便捷,增强清洁质量,有效减少工作者因繁重事务影响清洗质量,减少人为因素所致的不合格情况。因此对不可浸泡硬式内镜先行预处理的清洗质量明显较《规范》清洗标准更良好。这一结果与唐乃梅等[12]研究相符。本次研究结果证实,在可浸泡硬式内镜器械的清洗中采取超声喷淋+全自动清洗消毒机清洗合格率最高,表明超声喷淋+全自动清洗消毒机清洗有效避免器械清洗死角及盲区的忽视风险,且超声喷淋直接开展鲁沃夫多酶清洗液并同时给予超声清洗,由此提升器械清洗时间窗;且全自动清洁可杜绝工作者二次污染风险,减少器械表层微生物增殖风险。
目前,临床中对于硬式内镜清洗质量的初步评估多采取裸眼目测法,但裸眼目测法受到主观因素及工作者自身视力、意识、认知等影响,易造成清洗质量评价差异,尤其对部分硬式内镜伴有管腔类器械的观察易忽视[13]。本研究基于这类情况,为提升本次研究质量评估的准确性,选择10倍带光源放大镜检测降低裸眼观察的主观性与偏差。本研究发现10倍带光源放大镜检测依旧会受目测等主观因素干扰,如内镜器械表体因长期使用可造成细微划痕、受腐蚀等问题,从而造成不同程度的视觉偏差,若内镜保养不良将导致清洗效果打折,影响真实的评价结果,其检查结果较其他两种方法仍有一定差距。本研究结果发现,ATP生物荧光测试在评价硬式内镜清洗质量敏感度、准确性良好,与蛋白残留检测方式行Kappa一致性校验,两者检测效果相近,说明ATP生物荧光测试监测评估内镜器械洁净度效果良好,且检测耗时短、敏感度高,对硬式内镜清洗的持续质量控制有着积极意义。蛋白残留重点通过检测内镜器械表层残留的蛋白质,以定性与定量相结合的模式进行适度评估器械洁净度,蛋白残留检测方式具有便捷,结果判定准确、简单等优势。ATP生物荧光测试则是通过荧光素-荧光素酶与样本光子反应现象进行检测细菌等微生物所生成的ATP值[14],从而准确评估标本所含细菌生物量。
基于现阶段临床医疗中硬式内镜清洗实际状态,医疗机构需进一步提升硬式内镜清洗设备及相关工具的更新与管理,重视硬式内镜清洗消毒过程存在的潜在风险,结合自身情况制定与之相符的清洗消毒管理章程与标准,重视硬式内镜清洗各环节的细节管理,诸如内镜清洗观察中水源质量的控制,合理控制水温,避免清洗工具影响内镜洁净质量[15-16]。然而影响硬式内镜清洗效果的其他因素,如长短、材料、新旧等,我们在分组时各组间不存在差异,所以本文未做详细交代。此外,在实际清洗过程中也要考虑设备折旧问题,因为清洗过度会加速器械老化,增加成本和工作量,建议根据硬式内镜的使用需求差别对待。
综上所述,不可浸泡硬式内镜采用多酶原液预处理,可浸泡硬式内镜采取超声喷淋联合全自动清洗消毒机清洗,能够极大地提升清洗合格率;ATP生物荧光测试对硬式内镜清洁质量进行评估具有较高的可信度,检测结果准确,方便快捷。
[1]索晋柳,齐艳,郭燕,等.硬式内镜清洗消毒与灭菌效果检测方法研究进展[J].中国消毒学杂志,2016,33(2):174-177.
[2]田桂登,陈丹,刘贤婷,等.对内镜器械进行集中清洗消毒的效果评估[J].中国急救医学,2016,36(1):324-325.
[3]周好杨,任晓敏,张殷雷,等.消化内镜清洗消毒流程优化在消化科感染防控中的应用研究[J].检验医学与临床,2016,13(15):2151-2152.
[4]蔡雪花,许新建,毛坤剑,等.医用内窥镜系统的清洗消毒与保养方法研究[J].中国医学装备,2016,13(8):88-90.
[5]中华人民共和国卫生部.内镜清洗消毒技术操作规范[J].中国护理管理,2004,4(3):11-13.
[6]张辉琴,李静,吴晓英,等.硬式内镜器械清洗消毒集中式与分散式管理效果比较[J].中国消毒学杂志,2015,32(2):196-197.
[7]贺吉群,谢伏娟.硬式内镜清洗依从性问题和流程改进[J].中国内镜杂志,2012,18(3):304-306.
[8]李铁军,张海燕,姜伟,等.腹腔镜器械应用生物膜清洗剂与多酶清洗剂清洗效果比较[J].中国医学装备,2017,14(1):33-35.
[9]马久红.十二指肠镜感染风险与清洗消毒[J].世界华人消化杂志,2016,24(32):4337-4342.
[10]Angsuwatcharakon P,Rerknimitr R.Endoscopic closure of iatrogenic perforation[J].Gastrointest Intervention,2016,5(1):15-21.
[11]Garcia M,Gruev V.Optical characterization of rigid endoscopes and polarization calibration methods[J].Opt Express,2017,25(14):15713-15728.
[12]唐乃梅,姬小蔓,宋春,等.3种清洗剂作用复用手术器械时间与效果的相关性研究[J].新疆医科大学学报,2018,41(9):1163-1166.
[13]Lakshmanan V,Goutham MK,Karnaker V,et al.Prospective study on sterilization of rigid endoscopes in various otolaryngology clinics[J].Int J Otorhinolaryngol Head Neck Surg,2017,3(2):376.
[14]徐爱梅,钱小芳,邱华红,等.硬式内镜清洗效果监测分析[J].中华医院感染学杂志,2015(9):2154-2156.
[15]陈爱琴,陈寒艳,梁晓敏.硬式内镜器械清洗效果的检测方法探讨[J].中国消毒学杂志,2016,33(2):193-194.
[16]周翠玲.手术器械变色与清洗用水水质关系的观察研究[A].2014年河南省医院消毒供应中心(室)规范化建设与管理学术会议论文集[C].2014.
Study on the Effectiveness of Different Cleaning Procedures and Testing Methods for Rigid Endoscope