术前CTA预测急性A型主动脉夹层术后脑并发症的危险因素
引言
主动脉夹层是一种严重威胁生命的血管性疾病。除了夹层破裂和心包填塞以外,其主要的威胁来自夹层累积范围内所致的各分支动脉缺血所引发的并发症。各靶器官受累及率为:四肢10%~20%,肾脏15%,心肌10%,脑5%~15%,肠道及脊髓3%[1]。其中神经系统缺血由于起病隐匿、症状复杂多变以及处理的困难,被认为是主动脉夹层中最为棘手的并发症。脑缺血及栓塞是造成神经功能障碍的主要因素,即使术中脑灌注时间、停循环时间、脑保护时间、插管部位等因素控制在安全时限内,术后ND的发生率并未明显降低,其发生主要取决于病变本身的严重性和全身各器官功能状态[2]。但AD患者起病急、病情危重,术前多无法进行详细的神经系统筛查。
CTA目前是诊断主动脉夹层的有效手段。因扫描速度快,并可大范围扫描尤其适用于病变累及广泛的主动脉疾病。在我们的前期工作中已经成功进行头颈主动脉联合扫描,图像满足诊断需求[3]。本实验拟对急性Standford A型主动脉夹层行急诊外科手术治疗术后出现神经并发症患者,进行术前及术中资料分析,重点观察术前CTA影像资料与术后神经系统并发症有无相关性,以期能够为临床早期诊断及干预提供依据。
1 材料与方法
1.1 一般资料
回顾性收集2014年1月至2016年6月期间经急诊外科手术治疗的急性Standford A型主动脉夹层的患者,共255例,将所有患者分成三组:术后无神经系统功能不全组(No Neurological Dysfunction,NND);术后有永久性神经系统功能不全组(Permanent Neurological Dysfunction,PND)及术后有短暂性神经系统功能不全组(Temporary Neurological Dysfunction,TND);临床资料及术中指标作为变量,详见表1。
1.2 主动脉CTA扫描方法
采用西门子双源CT(Definition Flash, Siemens Healthcare, Forchheim, Germany)进行扫描,先做胸腹连续定位像扫描,再进行增强扫描(扫描范围:从颅底平面-耻骨联合水平),增强扫描采用德国欧利奇高压注射器,以5.0 mL/s的流率,肘前静脉注入60~70 mL非离子对比剂碘普罗胺注射液370 mgI/mL(Ultravist 370, 370 mgI/mL,Bayer Schering Pharma),对比剂注射完立即注射20~50 mL生理盐水。采用前瞻性心电门控大螺距扫描,应用造影剂跟踪法(bolus-tracking),在左心房内选择感兴趣区监测CT值,当感兴趣区内CT值达到100 HU时,延迟11 s自动触发扫描。扫描参数和重建参数:100 kV,110 mAs,自动毫安控制技术(CARE Dose 4D, Siemens),螺距3.2,准直2准直E Dos mm,每层厚1.0 mm,重建间隔0.8 mm,矩阵512间隔Do,显示野(FOV)200~320 mm,重建核B26f。
1.3 术后脑部神经系统并发症患者的CTA相关征象分析内容
由两位高年资心血管CT诊断医师详细分析所有病例的CTA图像中可能与神经系统并发症相关的重要CT征象:① 升主动脉段:观察内径,有无破口及并测量破口大小,有无内膜片逆行撕裂(逆行撕裂定义为:升主动脉段有内膜片撕裂但无破口);② 主动脉弓部:观察有无破口并测量破口大小;③ 颈总动脉:观察颈总动脉有无内膜片撕裂,是否起自假腔;④ 颈内动脉:观察颈内动脉近心段是否有内膜片撕裂累及,同时肉眼观察一侧颈内动脉是否较对侧密度减低;⑤ 椎动脉:观察椎动脉是否有内膜片撕裂累及,同时肉眼观察一侧椎动脉是否较对侧密度减低。
1.4 重要变量的定义
急性主动脉夹层指发病至手术时间<2周;术后脑神经系统并发症包括PND及TND。TND定义为术后出现可恢复的神经功能障碍,如一过性的意识障碍、谵妄、肢体张力增高、苏醒延迟、淡漠、帕金森症等。PND定义为术后出现新的神经功能障碍,如局灶损伤(脑卒中)、弥漫损伤(昏迷)、或术后2周内CT或MRI确定有新的局灶或弥漫损伤)[3]。急性肾衰竭:48 h内血肌酐上升>26.4 mmol/L或者大于基础值50%。
1.5 统计学分析
采用SPSS 17.0统计学软件进行分析。计数资料用例数(百分比)描述;计量资料采用均数表示。计数资料采用样本率或者构成频数表示,单因素分析P<0.1的变量引入采用多因素Logistic回归分析模型,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
255例患者中,仅院内术前急性肾功能衰竭三组间有统计学差异(P<0.05),余患者性别、年龄、一般临床特点等信息均无统计学差异(P>0.05),见表1。
2.2 急性A型主动脉夹层术后ND危险因素
255例急性A型主动脉夹层患者术后发生脑神经系统并发症共56例(21.96%),其中TND38例(14.90%),PND18例(7.06%),典型结果图,见图1。
术后TND患者相关因素分析结果,见表2。TND患者术前CTA显示:升主动脉直径略小于术后NND组,但两组差异无统计学意义(P>0.05)。但主动脉弓部破口及胸主动脉破口的发生明显高于术后NND组,两组差异有统计学意义(P<0.05)。颈总动脉夹层撕裂及一侧颈内动脉密度减低的发生率也明显高于术后NND组,两组有统计学差异(P<0.05)。Logistic回归分析显示主动脉弓部破口、颈总动脉夹层及一侧颈内动脉密度减低是术后TND的独立危险因素(P值均<0.05)。
术后PND患者相关因素分析结果,见表3。术后PND患者术前CTA显示:升主动脉逆行撕裂及主动脉弓部破口发生率明显高于术后NND组,两组差异有统计学意义(P<0.05)。Logistic回归分析显示升主动脉逆行撕裂及主动脉弓部破口是术后TND的独立危险因素(P值均<0.05)。
表1 255例患者术前和术中资料
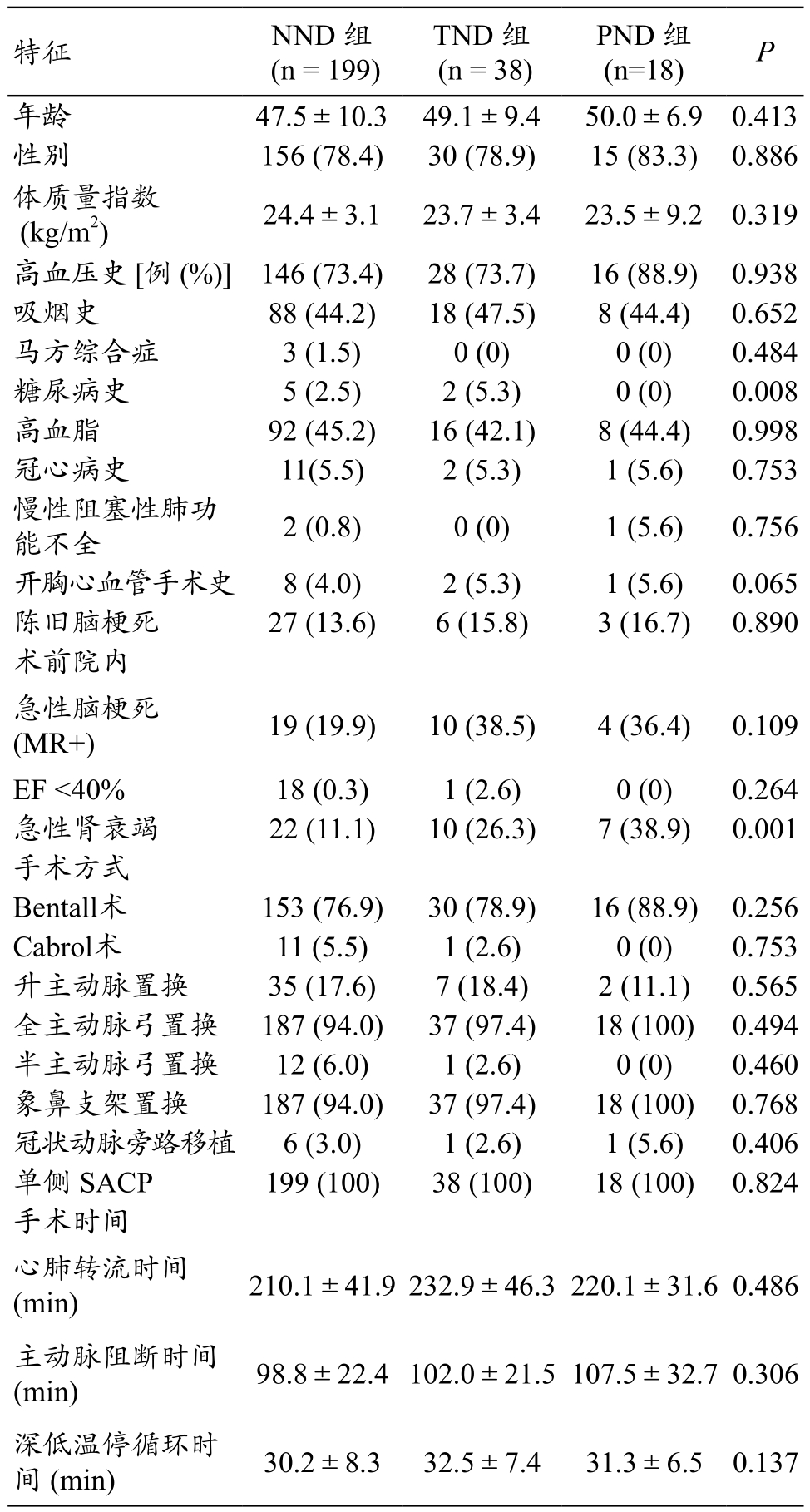
特征 NND 组(n = 199)TND 组(n = 38)PND 组(n=18) P年龄 47.5±10.3 49.1±9.4 50.0±6.9 0.413性别 156 (78.4) 30 (78.9) 15 (83.3) 0.886体质量指数(kg/m2) 24.4±3.1 23.7±3.4 23.5±9.2 0.319高血压史 [例 (%)] 146 (73.4) 28 (73.7) 16 (88.9) 0.938吸烟史 88 (44.2) 18 (47.5) 8 (44.4) 0.652马方综合症 3 (1.5) 0 (0) 0 (0) 0.484糖尿病史 5 (2.5) 2 (5.3) 0 (0) 0.008高血脂 92 (45.2) 16 (42.1) 8 (44.4) 0.998冠心病史 11(5.5) 2 (5.3) 1 (5.6) 0.753慢性阻塞性肺功能不全 2 (0.8) 0 (0) 1 (5.6) 0.756开胸心血管手术史 8 (4.0) 2 (5.3) 1 (5.6) 0.065陈旧脑梗死 27 (13.6) 6 (15.8) 3 (16.7) 0.890术前院内急性脑梗死(MR+) 19 (19.9) 10 (38.5) 4 (36.4) 0.109 EF <40% 18 (0.3) 1 (2.6) 0 (0) 0.264急性肾衰竭 22 (11.1) 10 (26.3) 7 (38.9) 0.001手术方式Bentall术 153 (76.9) 30 (78.9) 16 (88.9) 0.256 Cabrol术 11 (5.5) 1 (2.6) 0 (0) 0.753升主动脉置换 35 (17.6) 7 (18.4) 2 (11.1) 0.565全主动脉弓置换 187 (94.0) 37 (97.4) 18 (100) 0.494半主动脉弓置换 12 (6.0) 1 (2.6) 0 (0) 0.460象鼻支架置换 187 (94.0) 37 (97.4) 18 (100) 0.768冠状动脉旁路移植 6 (3.0) 1 (2.6) 1 (5.6) 0.406单侧 SACP 199 (100) 38 (100) 18 (100) 0.824手术时间心肺转流时间(min) 210.1±41.9232.9±46.3220.1±31.6 0.486主动脉阻断时间(min) 98.8±22.4102.0±21.5107.5±32.70.306深低温停循环时间 (min) 30.2±8.3 32.5±7.4 31.3±6.5 0.137
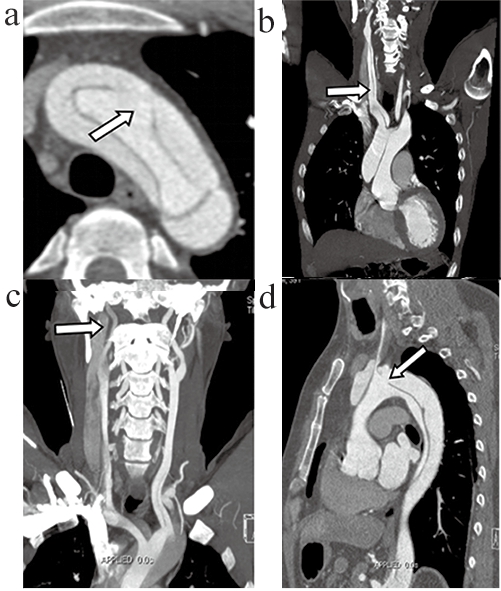
图1 急性A型主动脉夹层患者术后发生脑神经系统并发症图像显示
注:a. CTA轴位示主动脉弓部破口;b. 冠状位右侧颈总动脉全程内膜片撕裂;c. 冠状位显示右颈内动脉密度减低;d. 矢状位示升主动脉逆行撕裂,破口位于主动脉弓部。
3 讨论
急性Stanford A型主动脉夹层如采取保守治疗,患者2周内死亡率高达90%[2]。外科手术是目前最有效的治疗方案[3]。随着外科手术、麻醉、深低温停循环及脑保护等技术的提高,术后病死率明显降低,但术后脑神经系统损伤仍是常见的并发症之一[4]。
对主动脉夹层围手术期新发脑神经系统并发症分成PND及TND两种。本组患者术后总ND发生率为21.96%,PND发生率为7.06%及TND发生率为14.90%略低于已有研究报道的10%和20%[6-8],与国外研究相近[5]。
本组结果在临床资料结果提示术前急性肾衰竭是术后ND的危险因素,刘红等[4]研究结果显示术前血肌酐水平和术后TND相关,主动脉夹层患者常常伴随全身炎症反应严重炎性反应,会导致一定的肾脏的损伤,或许这些因素和术后发生TND相关。虽然在单因素分析中与术后ND发生具有相关性,但多因素分析中并无显著意义。
本组CT征象显示颈总动脉夹层、主动脉弓部破口及一侧颈内动脉密度减低这三种CTA征象是术后TND独立危险因素。这些征象均可证明弓上分支血管血流中断或低流量灌注,可导致脑缺血性损伤。术后TND与术前脑缺血有关[9-10]。A型主动脉夹层易累及颈总动脉撕裂是术后TND危险因素,但部分患者不一定出现脑中风[11-13],本研究结果显示当颈总动脉撕裂的假腔以血栓为主且存在破口时,术后出现ND的风险明显大于撕裂段没有再破口。这说明撕裂段存在再破口及假腔血栓是其重要的危险征象。对于上述征象的主动脉夹层患者,术中需特别注意血管重建时的操作及术中脑灌注选择及流量,建议最好采用双侧脑灌注[14]。
表2 术后TND病例相关因素分析

images/BZ_36_236_2279_2237_2373.pngCTA征象 升主动脉段直径 (mm) 51.2±10.6 50.5±8.0 0.700 — —升主动脉逆行撕裂 27 (19.6) 6 (28.9) 0.717 — —升主动脉段破口 172(86.4) 32 (84.2) 0.717 — —升主动脉破口大小 (mm) 1.96±1.6 2.0±1.0 0.948 — —主动脉窦瓣撕裂累及 63 (31.7) 12 (31.6) 0.992 — —主动脉弓部破口 100 (50.3) 29 (76.3) 0.003 2.827 0.034主动脉弓部破口大小 (mm) 11.6±8.5 8.9±8.1 0.133 — —胸主动脉起始破口 39(19.6) 2 (5.3) 0.032 0.306 0.170颈总动脉夹层 54 (27.1) 24 (63.2) 0.000 4.626 0.000颈总动脉起自假腔 2 (1.01) 2 (5.3) 0.062 — —一侧颈内动脉密度减低 21 (10.6) 12 (31.6) 0.001 3.019 0.021椎动脉夹层 13 (6.5) 2 (5.3) 0.768 — —一侧椎动脉密度减低 17 (8.5) 3 (7.9) 0.895 — —临床资料 — — — — —急性肾衰竭 22 (11.1) 10 (26.3) 0.001 0.616 0.415
表3 术后PND病例相关因素分析
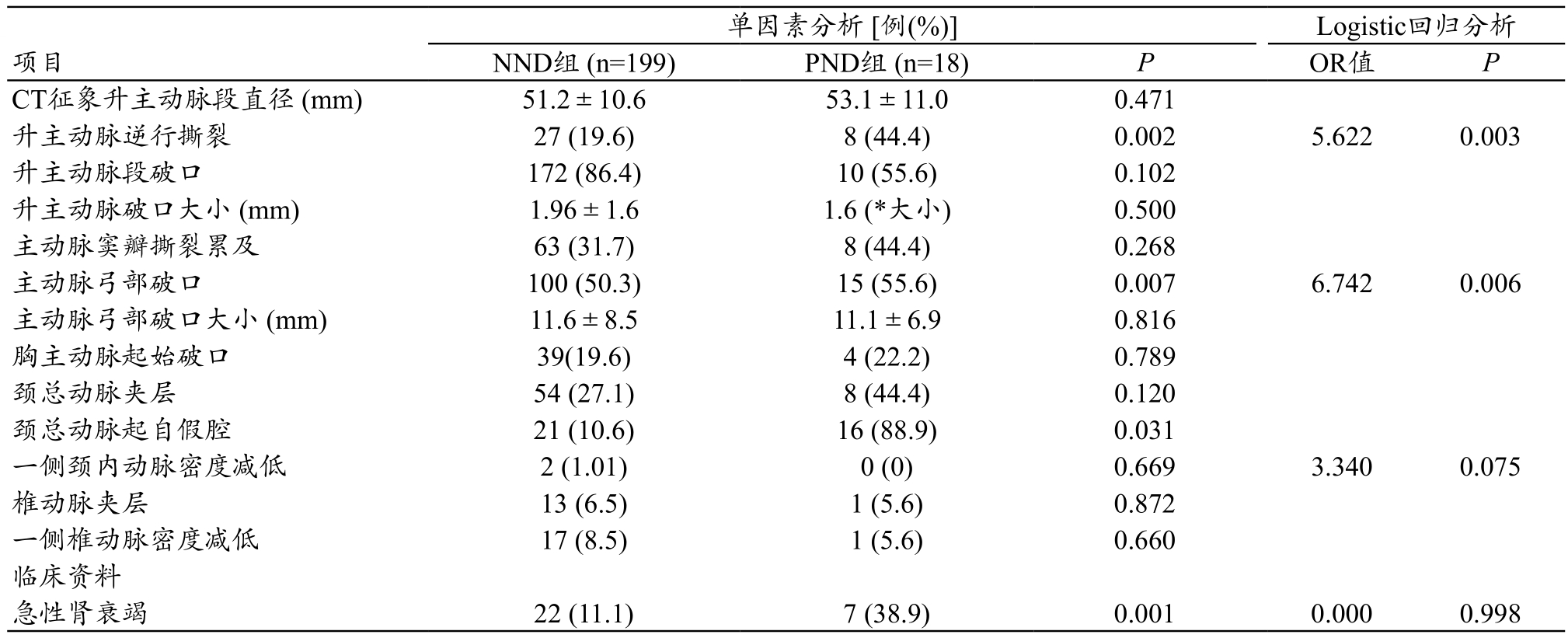
images/BZ_37_233_331_2234_425.pngCT征象升主动脉段直径 (mm) 51.2±10.6 53.1±11.0 0.471升主动脉逆行撕裂 27 (19.6) 8 (44.4) 0.002 5.622 0.003升主动脉段破口 172 (86.4) 10 (55.6) 0.102升主动脉破口大小 (mm) 1.96±1.6 1.6 (*大小) 0.500主动脉窦瓣撕裂累及 63 (31.7) 8 (44.4) 0.268主动脉弓部破口 100 (50.3) 15 (55.6) 0.007 6.742 0.006主动脉弓部破口大小 (mm) 11.6±8.5 11.1±6.9 0.816胸主动脉起始破口 39(19.6) 4 (22.2) 0.789颈总动脉夹层 54 (27.1) 8 (44.4) 0.120颈总动脉起自假腔 21 (10.6) 16 (88.9) 0.031一侧颈内动脉密度减低 2 (1.01) 0 (0) 0.669 3.340 0.075椎动脉夹层 13 (6.5) 1 (5.6) 0.872一侧椎动脉密度减低 17 (8.5) 1 (5.6) 0.660临床资料急性肾衰竭 22 (11.1) 7 (38.9) 0.001 0.000 0.998
主动脉弓部破口及升主动脉逆行撕裂是PND的独立危险因素,两个征象意味着升主动脉-主动脉弓段假腔内以血栓为主,如合并弓部破口,假腔血栓和粥样硬化斑块极易脱落经破口上行造成脑梗塞[14]。术前这些危险征象的检出有利于术者在术中提前选择在主动脉处于低张状态进行且轻柔使用阻断钳以防止斑块的脱落[15-16]。
本研究属于回顾性研究,可能存在一定的选择偏倚。因本实验为单中心数据,所以术后TND和PND患者组的样本量也较小,可能会影响结果的准确性。此外,对于该类患者长期的临床结果可能更重要,这也是我们下一步希望可以扩大样本量并对该类人群进行长期随访观察,以其可以更深入研究。
综上,急性Stanford A型主动脉夹层术后TND与术前颅脑低灌注有关,即术前CTA的征象(颈总动脉夹层、主动脉弓部破口及一侧颈内动脉密度减低)这提示临床术中更应关注患者的选择脑保护的方式。术后PND与术前升主动脉逆行撕裂、弓部破口有密切相关,这提示临床术中更应关注手术操作手法,从而减少ND的发生。
[1]Dumfarth J,Kofler M,Stastny L,et al.Stroke after emergent surgery for acute type A aortic dissection: predictors, outcome and neurological recovery?[J].Eur J Cardio-Thoracic, 2018,(53):1013-1020.
[2]罗海燕,胡克俭,刘祖赟,等.A型主动脉夹层术后脑部并发症危险因素分析[J].中华胸心血管外科杂志,2009,25(3):148-150.
[3]赵宏亮,郑敏文,段维勋,等.低剂量双源CT头颈主动脉联合扫描的可行性及在A型主动脉夹层的临床应用价值[J].中国医疗设备,2017,32(11):8-11.
[4]刘红,常谦,张海涛,等.急性Stanford A型主动脉夹层术后脑神经系统并发症的危险因素[J].中华胸心血管外科杂志,2014,30(6):342-345.
[5]Conzelmann LO,Hoffmann I,Blettner M,et al.Analysis of risk factors for neurological dysfunction in patients with acute aortic dissection type A: data from the German Registry for Acute Aortic Dissection type A(GERAADA)[J].Eur J Cardiothorac Surg,2012,42(3):557-565.
[6]Bossone E,Corteville DC,Harris KM,et al.Stroke and outcomes in patients with acute type A aortic dissection[J].Circulation,2013,128(S1):175-179.
[7]赵宏亮,王晋,郑敏文,等.CTA对急性A型主动脉夹层术前头颈血管评估应用价值研究[J].医疗卫生装备,2018,61-64.
[8]Krüger T,Weigang E,Hoffmann I,et al.Cerebral protection during surgery for acute aortic dissection type A: results of the German registry for acute aortic dissection type A (GERAADA)[J].Circulation,2011,124(4):434-443.
[9]Khaladj N,Shrestha M,Meck S,et al.Hypothermic circulatory arrest with selective antegrade cerebral perfusion in ascending aortic and aortic arch surgery: a risk factor analysis for adverse outcome in 501 patients[J].J Thoracic Cardiovasc Surg,2008,135(4):908-914.
[10]Haldenwang PL,Wahlers T,Himmels A,et al.Evaluation of risk factors for transient neurological dysfunction and adverse outcome after repair of acute type A aortic dissection in 122 consecutive patients[J].Eur Cardiothorac Thorac,2012,42(5):115-120.
[11]Buonocore M,Amarelli C,Scardone M,et al.Cerebral perfusion issues in acute type A aortic dissection without preoperative malperfusion: how do surgical factors affect outcomes[J].Eur J Cardiothorac Surg,2016,50:652-659.
[12]马贵洲,徐荣和,余丹青,等.主动脉夹层神经系统并发症的研究进展[J].心血管病学进展,2010,31(3):422-426.
[13]Wen D,Zhao H,Duan W,et al.Combined CT angiography of the aorta and craniocervical artery: a new imaging protocol for assessment of acute type A aortic dissection[J].J Thorac Dis,2017,9(11):4733.
[14]Gaul C,Dietrich W,Friedrich I,et al.Neurological symptoms in type A aortic dissections[J].Stroke,2007,38(2):292-297.
[15]Liu H,Chang Q,Zhang HT,et al.Predictors of adverse outcome and transient neurological dysfunction following aortic arch replacement in 626 consecutive patients in China[J].Heart Lung Circul,2016:S1443950616300026.
[16]Matsubara S,Koga M,Ohara T,et al.Cerebrovascular imaging of cerebral ischemia in acute type A aortic dissection[J].J Neurol Sci,2018,388:23-27.
Analysis of CTA Risk Factors of Postoperative Neurological Complications of Acute Stanford Type A Aortic Dissection