OMAR迭代去伪影技术与双能量线性融合去伪影技术的对比性研究
引言
随着医用材料的发展,人体内金属植入物手术日益增多。因此,准确定位术后内固定物位置,判断术后并发症的有无,以及为后期治疗提供更准确的影像诊断变得极其重要。常规CT图像,椎体内固定螺钉周围会由于线束硬化和光子饥饿产生条带状暗影[1],严重影响螺钉周围结构的观察和术后效果评估,同时降低了影像科医生的诊断准确率,容易造成误诊和漏诊。随着设备的进步,各种去金属伪影技术也使这一问题得到了一定程度的解决,包括能谱CT[2]和双能量CT[3]。飞利浦OMAR(Orthopedic Metal Artifact Reduction)迭代算法是基于线性内插法的可去除金属伪影的重建算法[4]。双能量线性融合去伪影技术是基于双能量成像模式下两组不同能量图像使用线性插值方法得到的融合图像。本研究使用两种不同去伪影技术对椎体固定术后患者做CT扫描后的重建,与常规图像进行对比,探讨OMAR迭代去伪影技术与双能量线性融合去金属伪影技术的效果差异。
1 材料与方法
1.1 一般资料
收集2018年6~11月在我院行腰椎内固定术后患者28例,胸椎内固定术后患者22例。患者临床诊断为腰椎间盘突出、椎管狭窄、脊柱侧弯及椎体骨折等疾病。所有患者术后2 d内使用Philips 256iCT行螺旋扫描观察植入螺钉固定位置情况。术后3个月复查使用西门子Flash CT(Siemens Somatom Definition Flash Dual-source CT)双能量扫描。患者年龄14~65岁,平均年龄32.58±6.23岁,男性28例,女性22例。纳入标准:患者均行椎体内固定术,因评估术后情况及术后有临床症状而由临床医师开具检查申请单。本研究已获本院医学伦理委员会批准。
1.2 检查方法
患者行椎体内固定术后2 d由临床医师开具CT椎体三维重建申请单,行CT椎体三维重建。扫描使用Philips 256iCT。扫描条件为120 kV,管电压150~350 mAs,扫描层厚128×0.67。扫描野(Field of View,FOV)根据受检者体型具体选择[5]。扫描后使用常规滤波反投影算法(Filtered Back Projection,FBP)和OMAR迭代算法分别重建两组薄层图像,重建层厚1 mm,重建层距1 mm,重建矩阵512×512。常规FBP算法所得图像为A组,OMAR迭代算法所得图像为B组图像。术后3月患者复查时使用Siemens Somatom Flash双源CT。双能量模式螺旋扫描,140/80 kV,80/380 mAs,扫描层厚128×0.6mm。重建融合系数-0.3,重建函数常规函数,重建层厚1 mm,重建层距1 mm,所得融合图像为C组。
1.3 图像评价
1.3.1 图像主观评价
所有薄层图像均传输至飞利IntelliSpace Portal星云后处理工作站,3组数据分别由2名放射科主治医师以互盲形式,采用Compare软件两两对照评价法,通过最大密度投影(Maximum Intensity Projection,MIP)、多平面重组(Muti-Planner Reconstruction,MPR)等方式在相同位置、相同窗宽窗位的条件下进行对照观察,图像评分标准参考Gondim 5分法[6]:1分表示伪影很重,无法辨认正常结构;2分表示辨认结构比较困难;3分表示能辨认结构,但信心较低;4分表示能辨认结构,信心中等;5分表示能辨认结构,信心较高。两名医师的评分取均值纳入统计分析。
1.3.2 图像客观评价
使用飞利浦自带Compare软件两两对照评价法对原始数据轴位数据进行客观评价。分别在两组原始图像选取显示金属螺钉较多层面,测量螺钉前后1 cm处,面积约1 cm2的ROI内的SD值,作为图像噪声的客观评价指标[7],通过3次测量取均值纳入统计分析。
1.4 统计学分析
对主观评分数据和客观测量数据均取均值纳入SPSS 17.0软件包进行统计分析。3组间比较采用方差分析,两两比较采用LDS检验,以P<0.05为差异有统计学意义。
2 结果
同一腰椎内固定患者L3椎体螺钉层面图像,见图1。OMAR迭代去伪影图像显示金属螺钉周围伪影最少,几乎没有伪影影响,图像质量最佳;双能量线性融合去伪影图像显示金属螺钉前缘有部分伪影,螺钉后缘伪影较少,硬膜囊受伪影影响小,不影响诊断;常规组FBP重建图像显示金属螺钉前后缘伪影较重,硬膜囊受伪影影响,影响诊断。
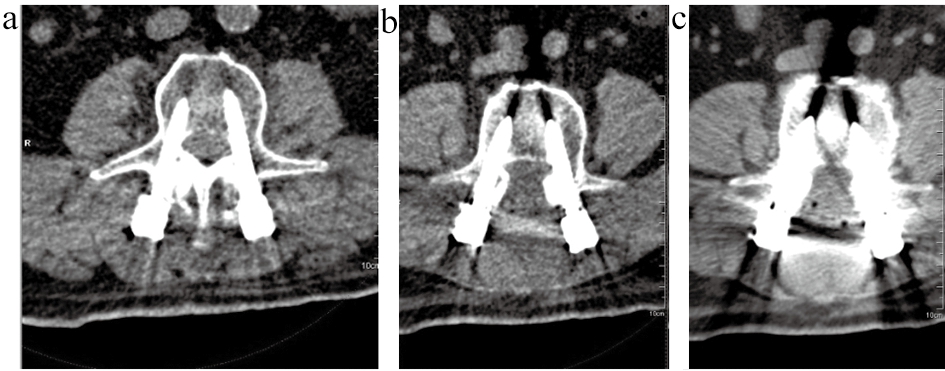
图1 同一腰椎内固定患者L3椎体螺钉层面
注:a图为OMAR迭代去伪影图像;b图为双能量线性融合去伪影图像;c图为常规组FBP重建图像。
一例典型的(患者男,22岁)脊椎侧弯,胸腰段金属内固定术后图像结果,见图2。矢状位OMAR迭代去伪影图像显示椎体前后缘金属伪影较少,硬膜囊显示较清晰,诊断影响不大;矢状位常规组FBP重建图像显示椎体前后缘金属伪影较大,硬膜囊显示欠佳,对诊断影响较大。
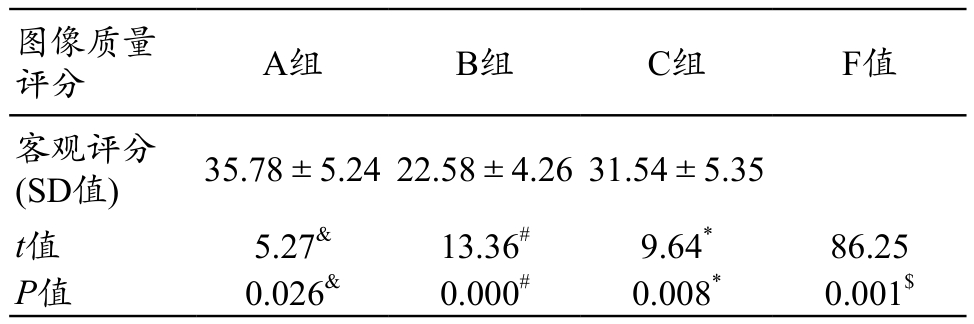
图像主观评分中,两名医生间的一致性均较好(K=0.675,P<0.05)。3组 图 像 质 量 评 分 分 别 为 A 组3.15±4.26,B 组 4.15±0.35,C 组 3.54±4.26;A 组vs B组 P=0.006,A组 vs C组 P=0.254,B组 vs C组P=0.014。3组图像客观质量比较结果中,SD值分别为A组 36.78±5.24,B 组 22.5±5.35,C 组 31.54±4.26;A组 vs B组 P=0.000,A组 vs C组 P=0.026,B组 vs C组P=0.008。由此可见,B组图像质量的主观评分最高,且客观评分SD值最低(表1~2)。
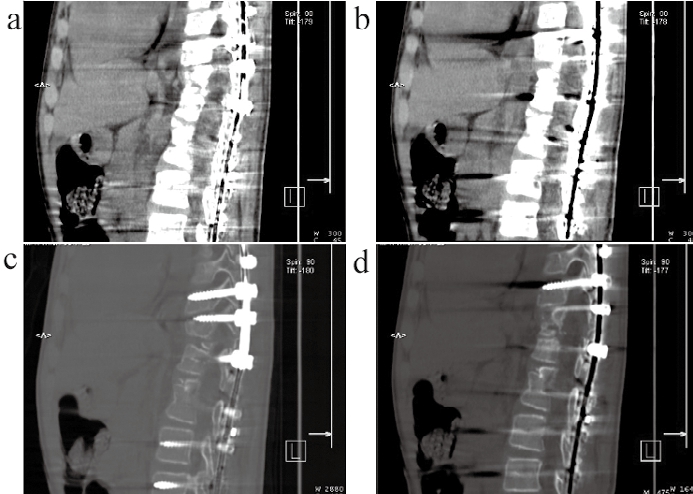
图2 脊椎侧弯,胸腰段金属内固定术后图像
注:a和c为矢状位OMAR迭代去伪影图像;b和d为矢状位常规组FBP重建图像。
表1 三组图像主观评分比较(
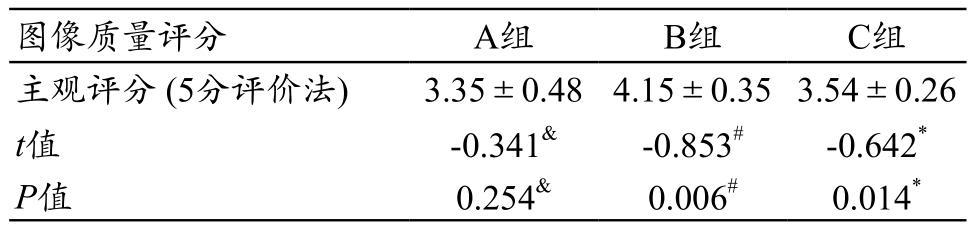
注:#表示A组与B组比较;*表示B组与C组比较;&表示A组与C组比较。
images/BZ_32_236_1084_1193_1137.png主观评分 (5分评价法) 3.35±0.48 4.15±0.353.54±0.26 t值 -0.341& -0.853# -0.642*P值 0.254& 0.006# 0.014*
表2 三组图像客观图像质量的比较(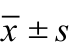 )
)
注:#表示A组与B组比较;*表示B组与C组比较;&表示A组与C组比较;$表示A、B、C组3组间比较的方差分析。
图像质量评分 A组 B组 C组 F值客观评分(SD值) 35.78±5.2422.58±4.2631.54±5.35 t值 5.27& 13.36# 9.64* 86.25 P值 0.026& 0.000# 0.008* 0.001$
3 讨论
骨科外科治疗中常需要放置金属螺钉固定椎体用于治疗椎体病变。对于椎体内固定术后患者需要对金属植入物位置、有无裂痕、继发感染、对临近组织有无压迫等情况进行评估[8]。CT螺旋扫描作为评价椎体内固定术后效果的最高效手段可对金属内固定螺钉进行多方位分析评价。同时金属内固定螺钉在扫描时会产生严重的放射状线束硬化伪影,影响CT图像对内固定手术的评估。所以,在CT检查中如何安全有效地去除金属伪影带来的影响,提高图像质量称为急需解决的问题。
金属伪影产生的根本原因与金属本身的高衰减系数造成的光子饥饿效应有关,同时还包括很多因素,如噪声、射线硬化、部分容积效应、散射线、能谱硬化等[9]。金属伪影的严重程度也受许多因素的影响,包括金属自身特性、管电压、管电流、重建层厚、重建算法等[10]。金属伪影严重降低图像质量,影响临近结构的显示与观察[11]。常规可通过物理前置过滤、双能量扫描及不同后处理算法来校正金属产生的伪影[12-14]。双能量成像技术是相对高级的重建技术,可减轻射线硬化伪影,但对光子饥饿效应产生的伪影却效果不佳,改变不大。脊柱椎体植入物造成伪影直接影响了椎体前后缘软组织显示,尤其是主动脉及周围肌肉的观察。OMAR为一种改进的迭代重建技术,是目前较先进的去伪影技术,对图像的迭代重建只针对金属像素而对非金属图像不造成影响[15]。本研究通过测量A、B、C三组金属螺钉前后缘的SD值来客观判断去伪影效果,同时采用主观评分来评估3组图像的图像质量,以此来比较OMAR迭代重建技术与双能量线性融合去伪影技术的优劣。结果显示OMAR迭代重建技术可以有效减少金属伪影提高图像质量,可显著改善金属螺钉后缘多裂肌、竖脊肌及螺钉前缘主动脉血管的图像噪声,减少金属植入物造成的伪影,使细微关键结构可视化[14]。虽然OMAR没有完全去除金属伪影,但能够减少伪影对CT图像质量的影响,显著增加图像的信噪比,提供更多的诊断信息。主观与客观评价结果均充分证明OMAR迭代重建技术去除金属伪影有效,并且图像质量较高。
双能量线性融合去伪影技术是利用高低千伏射线穿透能力的不同将两组图像进行融合所得到的图像。高能射线穿透金属螺钉能力强,伪影较少,但图像中软组织噪声较大。低能射线穿透金属螺钉能力弱,伪影较多,但图像中软组织噪声较小。将两种高低能量图像按比例进行融合获得去伪影图像。但此方法无法解决光子饥饿效应产生的条索状伪影,同时在图像细节显示能力不足。这也是双能量C组图像噪声、SNR、主观得分低于B组的原因所在。其次,双能量扫描模式有效FOV较小,包含范围小,不适用于范围较大部位的金属植入物扫描,如肩关节置换,双侧股骨头置换术等。OMAR迭代重建技术为全扫描野重建,适用于任何部位,包含信息全面,不会产生信息缺失。
OMAR迭代重建去伪影技术与传统去伪影技术所采用的插值技术不同。传统插值技术是替换掉原始投影数据中受金属异物污染的数据来达到去除金属伪影的目的,但容易产生次生伪影。OMAR是对图像中的物质结构重新定义和分类,再对所定义的不同组织对应的投影数据进行反复对比迭代运算,寻找出原始数据中金属伪影对应的投影数据并从中剔除。如此反复迭代,直至图像中没有大簇的金属像素存在,最终得到去伪影重建图像[15]。所以,OMAR迭代重建技术对图像的迭代重建只针对图像中金属像素而不会影响非金属因素[15]。这也是OMAR迭代重建去伪影技术能清晰显示金属螺钉螺纹等细节的原因所在。Li等[16]针对OMAR进行了系统和定量的分析和研究,发现其去伪影能力更强,不仅能提供更清晰的解剖结构,而且可以避免金属伪影区域影像密度的主观误判。
本研究重点关注各组图像之间的图像质量,使用ROI的SD值作为评价图像噪声指标。虽然SD值已广泛用于图像质量的评估,但不能排除定量参数可能并没有真正衡量图像的质量。同时选择金属固定物的部位较为单一,缺少其他部位的金属植入物进行对比,需要扩大研究范围,进一步证明OMAR技术图像描述的准确性。
综上所述,OMAR迭代重建去伪影技术能够有效地抑制图像噪声,去除金属伪影对图像质量的影响,使金属植入物周围组织结构能够清晰显示。OMAR迭代重建去伪影技术对比双能量线性融合去伪影技术在细微结构及细节处显示能力较好,图像质量更高,为临床提供更多有价值的诊断信息。
[1]Barrett JF,Keat N.Artifacts in CT: Recognition and avoidance[J].Radiographics,2004,24(6):1679-1691.
[2]贾勇军,张志远,马凤.能谱CT单能量成像在减少腰椎内固定术后金属伪影的临床价值[J].实用放射学杂志,2013,29(5):815-818.
[3]潘昌杰,钱农,薛跃君,等.双能量CT单能谱成像技术在骨折金属固定术后的应用[J].中华放射学杂志,2011,45(5):496-499.
[4]乐先杰,崔凤.256 iCT O-MAR技术在腰椎内固定术后评估中的应用[J].浙江创伤外科,2014,19(4):633-634.
[5]储斌,邹月芬,王传兵.多排螺旋CT不同扫描参数及图像后处理方式对金属伪影的影响[J].实用放射学杂志,2015,3(7):1193-1197.
[6]Gondim TPA,Meyer JB, Baumann C,et al.Total hip prosthesis CT with single-energy projection-based metallic artifact reduction: impact on the visualization of specific periprosthetic soft tissue structures[J].Skeletal Radiol,2014,43(9):1237-1246.
[7]王素雅,高剑波,刘杰,等.迭代模型重建技术在肺动脉“双低”成像中的应用研究[J].实用放射学杂志,2016,32(12):1940-1944.
[8]唐启瑛,阎作勤,陆秀良,等.320排CT去金属伪影在评价腰椎内固定术后情况的临床应用价值[J].实用放射学杂志,2015,31(11):1824-1827.
[9]Subhas N,Primak AN,Obuchowski NA,et al.Iterative metal artifact reduction: evaluation and optimization of technique[J].Skeletal Radiol,2014,43(12):1729-1735.
[10]Shinohara Y,Sakamoto M,Iwata N,et al.Usefulness of monochromatic imaging with metal artifact reduction software for computed tomography angiography after intra cranial aneurysm coil embolization[J].Acta Radiol,2014,55(8):1015-1023.
[11] 潘自兵,赵凯,海录,等.能谱CT成像技术在减除金属植入物伪影方面的应用价值[J].实用放射学杂志,2015,31(6):1014-1017.
[12]李庆亮,闫镔,孙宏胜,等.X-CT金属伪影校正方法综述[J].CT理论与应用研究,2011,20(1):131-140.
[13]Bamberg F,Dierks A,Nikolaou K,et al.Metal artifact reduction by dual energy computed tomography using monoenergetic extrapolation[J].Eur Radiol,2011,21(7):1424-1429.
[14]Mahnken AH,Raupach R,Wildberger JE,et al.A new algorithm for metal artifact reduction in computed tomography: in vitro and in vivo evaluation after total hip replacement[J].Invest Radiol,2003,38(12):769-775.
[15]惠萍,王新江,崔志鹏,等.CT能谱成像在消除金属移植物伪影中的应用价值[J].中华放射学杂志,2011,45(8):740-742.
[16]Hilgers G,Nuver T,Minken A.The CT number accuracy of a novel commercial metal artifact reduction algorithm for large orthopedic implants[J].ApplClin Med Phys,2014,15(1):4597.
[17]Li H,Noel C,Chen H,et al.Clinical evaluation of a commercial orthopedic metal artifact reduction tool for CT simulations in radiation therapy[J].Med Phys,2012,39(12):7507-7517.
Comparative Study of OMAR Iterative De-artifact Technique and Bienergy Linear Fusion De-Artifact Technique