专论——显微CT临床应用与质量控制
编者按:自CT诞生以来,CT技术发展异常迅猛,从大范围快速检查、心血管检查、器官动态灌注检查、到低剂量成像等,CT解决了检查成功率与安全性的难题。而如今,CT关注的重点从“扫描成功”转化到了“诊断成功”,CT影像的发展方向发生了重要转变,对影像链硬件技术、图像重建算法、计算机智能辅助诊断的研发,都朝着“影像精准,技术先行,诊断精准,影像先行”的方向推进!
显微CT的新技术:气垫轴承、0.27 s转速,硬件无磨损、实现心血管无忧检查;节段阳极球管、“透心凉”技术,实现高达500万秒次曝光的超长寿命;从纳米到微平板,到高度集成化探测器,独有球面设计,1024矩阵数据采集,实现高清成像。显微CT突破了密度分辨率瓶颈,展示了CT新的发展方向——“类MR成像”:① 提升密度分辨率,获得类似MR的高软组织成像;② 大幅降低辐射剂量,朝着MR的无辐射成像方向接近;③ 亚毫米薄层诊断,减少部分容积效应,利于病灶早期发现。
本期推出“显微CT临床应用与质量控制”专题,介绍了1024超高分辨率成像的临床优势;IMR全模型迭代和其他算法的比较和临床应用;显微CT扫描参数和扫描流程的优化,提升扫描及诊断成功率等研究,进一步提高图像质量,扩展其临床应用。希望通过本期栏目,显微CT的临床应用更加广阔,并给广大关注显微CT发展的放射影像同仁提供更多更广的研究思路。
栏目主编:石明国

石明国,空军军医大学(原第四军医大学)西京医院医学影像学教研室主任、教授;山东泰山医学院兼职教授、硕士生导师。多次荣获第四军医大学优秀教师称号、荣立三等功2次、2012年1月荣获国防服役金质奖章;获得全国、全军医学影像技术学科建设终身成就奖、首席专家、“伦琴学者”等荣誉。
中华医学会医学影像技术学会第六届委员会主任委员、中国医学装备协会常务理事、中国医学装备协会CT工程技术专业委员会主任委员、中国人民解放军医学影像技术专业委员会主任委员、陕西省医学会医学影像技术学会第二、三届主任委员。中华医学科技奖评审委员会委员,第一届全国高等学校医学影像技术专业教材评审委员会副主任委员。先后受聘为《中华放射学杂志》副总编辑、《实用放射学》《国际医学放射学》《生物医学工程与临床》《中华现代影像学》等10余部杂志期刊编委、常务编委、副主编。
长期从事放射医学影像新技术应用和CT图像重建后处理及医学影像设备临床应用研究及教学工作,特别在CT设备的管理、质控、教学和临床应用上造诣较深。先后承担国家九五攻关课题1项、获陕西省科学技术二等奖2项、全军科技进步三等奖5项、承担国家自然科学基金项目多项、获国家发明专利3项。主持开展具有国内、军内先进水平的医学影像技术临床应用新业务、新技术多项。
主编专著及教材21部,副主编4部,参编多部。1995年主编全国首部《实用CT影像技术学》,获优秀科技图书一等奖,1996年该书被选为全国大型设备CT上岗培训教材,为我国培养了一大批医学影像技术专业应用人才。主编“十一五”“十三五”国家级规划教材《医学影像设备学》《医学影像设备质量控制管理学》《放射师临床工作指南》《医用影像设备(CT/MR/DSA)成像原理与临床应用》《放射医学技术-高级教程》《现代CT设备质控管理与操作规范》等专著多部,分别由高等教育出版社和人民卫生出版社出版。在专业杂志发表论文160余篇,其中多篇获优秀论文奖。
显微CT靶重建和IMR技术对胰腺图像质量的影响
引言
随着多层螺旋CT(Multi-Slice Spiral CT,MSCT)技术的发展,其空间分辨率和密度分辨率逐步提高,促使胰腺增强CT的临床应用越来越广泛[1-2]。胰腺形态较小,正常胰腺头、体、尾仅2 cm左右,长度仅15 cm左右[3-4],并且胰腺长轴和CT扫描层面平行,易受胰周结构、呼吸和腹部运动的影响而干扰诊断。已有研究报道,小于1 cm的胰腺癌CT敏感性较低[5-6],并且胰腺大多为乏血供肿瘤[7],对图像对比度要求较高。本研究通过靶重建技术和IMR技术,旨在提高胰腺CT扫描的图像质量,并且提高胰腺病变的检出率。
1 材料与方法
1.1 一般材料
收集2018年8至11月间,临床可疑胰腺占位性病变的50例资料,进行了显微CT增强扫描。入选标准:临床可疑胰腺病变,需要进行胰腺增强的患者。排除标准:严重心肾功能不全、碘对比剂过敏患者、有呼吸运动影响胰腺观察的患者。本研究通过医院医学伦理委员会审批通过。在患者知情的情况下与其签署知情同意书,将患者按照重建方式的不同分为常规组A组,滤波反投影算法(Filtered Back Projection,FBP)和显示野大小FOV为300;B组为FBP和FOV150;C组为全模型迭代重建技术(Iterative Model Reconstruction Algorithm,IMR)和 FOV150。其中男28例,女22例,年龄24~77岁,平均年龄57岁。
1.2 扫描技术
采用飞利浦i256层螺旋CT(Philips Brilliance iCT 256)进行扫描,先做腹部定位像扫描,再进行增强扫描。扫描范围:从肝顶-脐水平。扫描参数:管电压为120 kV,管电流为300 mAs,管电流自动调制技术(DoseRight,Philips Healthcare),准直256×0.6 mm,重建每层1.0 mm/0.8 mm,矩阵512×512,显示野(FOV)300 mm和150 mm,机架旋转时间0.4 s,螺距(pitch)0.925,重建函数标准。增强扫描采用德国欧利奇高压注射器,以3.5 mL/s的流率,在肘前静脉注入70 mL非离子对比剂典比乐370 mgI/mL,对比剂注射完立即注射40 mL生理盐水。动脉期采用自动触发扫描监测层面为腹主动脉阈值180 HU,静脉期为动脉期扫描后延迟25 s。
1.3 图像后处理及图像质量主观评价方法
常规组A组,原始数据经FBP重建和FOV300;B组为FBP和FOV150;C组原始数据经IMR重建和FOV150。所有图像在工作站进行多平面重组(Multiplanar Reformation,MPR),最大密度投影(Maximum Intensity Projection,MIP)及容积再现技术(Volume Rendering Technique,VRT)等后处理。
由两名有经验的医师分别对50例患者的图像(轴位断层,MPR,MIP,VRT)进行综合评价,分为4级:1级为优,边界显示清,无伪影,噪声低,定为1分;2级为良,边界轻度模糊,轻度伪影,适度噪声,定为2分;3级为差,边界模糊,明显伪影,噪声较大,但能做出诊断,定为3分;4级为不可诊断图像,边界不清,严重伪影,噪声大,无法评价定为4分。对评价不一致的,两人再协商取得一致意见。
1.4 图像质量客观评价方法
分别测量腹腔干层面的腹主动脉CT值和噪声,测量胰腺周围脂肪噪声和腰大肌的CT值,计算信噪比(Signal Noise Ratio,SNR)和对比噪声比(Contrast Noise Ratio,CNR)。SNR=腹主动脉CT值/脂肪噪声;CNR=(腹主动脉CT值-腰大肌CT值)/脂肪噪声。测量胰腺头、体和尾部的CT值和噪声,注意测量时避开钙化、囊变、血管和肿瘤。测量示意图,见图1。
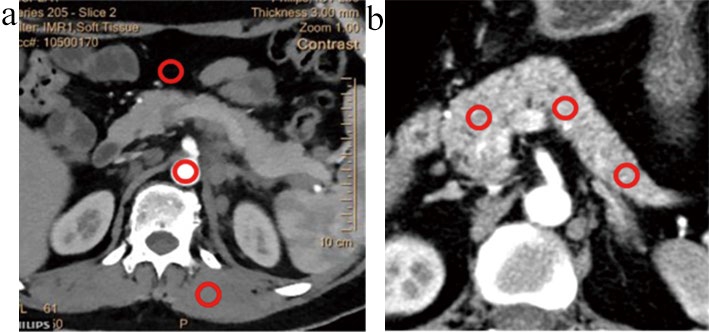
图1 三组图像质量客观评价方法中兴趣区测量的位置示意图
1.5 统计学分析
采用SPSS 19.0软件,定量数据使用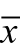 ±s。采用单因素方差分析对图像质量客观数据进行比较分析,方差分析平均数的两两比较使用LSD法,图像质量评分采用Mannwhitney u非参数检验,以P<0.05为差异有统计学意义。
±s。采用单因素方差分析对图像质量客观数据进行比较分析,方差分析平均数的两两比较使用LSD法,图像质量评分采用Mannwhitney u非参数检验,以P<0.05为差异有统计学意义。
2 结果
所有50例患者均顺利完成检查,其中胰腺炎21例,胰腺肿瘤26例,其余3例正常。男28例,女22例,年龄24~77岁,平均年龄57岁;患者平均体重为(61.812±7.122)kg;平均身高为(1.623±0.142)m;平均体重指数为(24.412±1.331)kg/m2;所有患者的扫描范围为(18.278±1.655)cm。
三组患者客观图像质量评价结果见表1~2。3组间动脉期和静脉期主动脉CT值、胰腺头、体、尾CT值的测量结果均没有差异性(P>0.05)。而图像噪声、SNR和CNR比较中,有统计学差异性。其中A和B组间没有统计学差异性(P>0.05);靶重建后图像噪声较A组稍微增大。而C组较B组在图像噪声和SNR、CNR比较中有明显统计学差异性,噪声降低了约60%,对比度增加了约60%(图2~3)。
表1 三组动脉期客观数据测量结果(
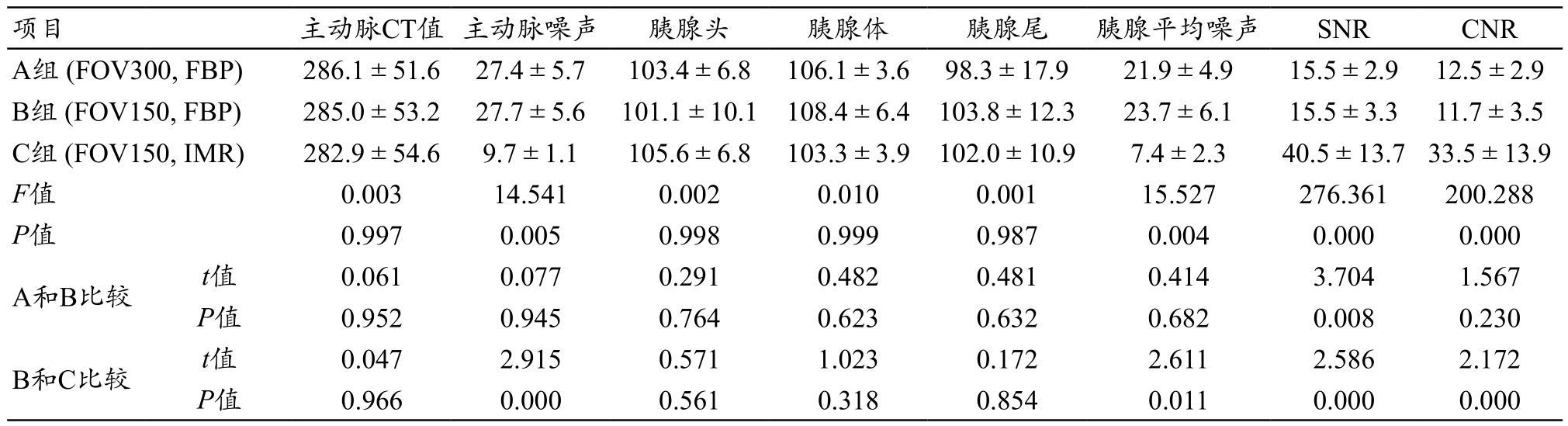
images/BZ_10_236_1919_2240_1973.pngA组 (FOV300, FBP) 286.1±51.6 27.4±5.7 103.4±6.8 106.1±3.6 98.3±17.9 21.9±4.9 15.5±2.9 12.5±2.9 B组 (FOV150, FBP) 285.0±53.2 27.7±5.6 101.1±10.1 108.4±6.4 103.8±12.3 23.7±6.1 15.5±3.3 11.7±3.5 C组 (FOV150, IMR) 282.9±54.6 9.7±1.1 105.6±6.8 103.3±3.9 102.0±10.9 7.4±2.3 40.5±13.7 33.5±13.9 F值 0.003 14.541 0.002 0.010 0.001 15.527 276.361 200.288 P值 0.997 0.005 0.998 0.999 0.987 0.004 0.000 0.000 A和B比较 t值 0.061 0.077 0.291 0.482 0.481 0.414 3.704 1.567 P值 0.952 0.945 0.764 0.623 0.632 0.682 0.008 0.230 B和C比较 t值 0.047 2.915 0.571 1.023 0.172 2.611 2.586 2.172 P值 0.966 0.000 0.561 0.318 0.854 0.011 0.000 0.000
表2 三组静脉期客观数据测量结果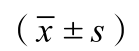
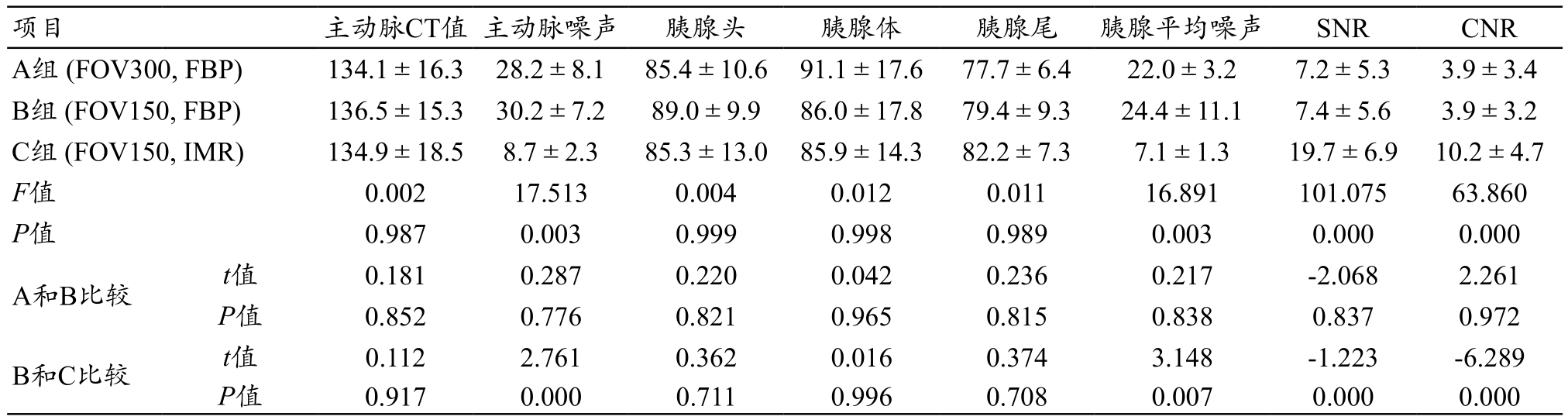
images/BZ_10_236_2532_2243_2585.pngA组 (FOV300, FBP) 134.1±16.3 28.2±8.1 85.4±10.6 91.1±17.6 77.7±6.4 22.0±3.2 7.2±5.3 3.9±3.4 B组 (FOV150, FBP) 136.5±15.3 30.2±7.2 89.0±9.9 86.0±17.8 79.4±9.3 24.4±11.1 7.4±5.6 3.9±3.2 C组 (FOV150, IMR) 134.9±18.5 8.7±2.3 85.3±13.0 85.9±14.3 82.2±7.3 7.1±1.3 19.7±6.9 10.2±4.7 F值 0.002 17.513 0.004 0.012 0.011 16.891 101.075 63.860 P值 0.987 0.003 0.999 0.998 0.989 0.003 0.000 0.000 A和B比较 t值 0.181 0.287 0.220 0.042 0.236 0.217 -2.068 2.261 P值 0.852 0.776 0.821 0.965 0.815 0.838 0.837 0.972 B和C比较 t值 0.112 2.761 0.362 0.016 0.374 3.148 -1.223 -6.289 P值 0.917 0.000 0.711 0.996 0.708 0.007 0.000 0.000
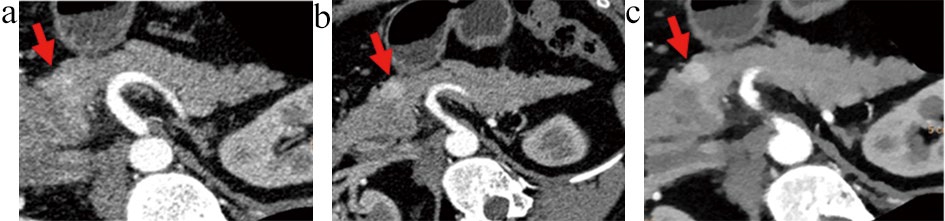
图2 患者1靶重建和IMR重建图像
注:患者女,63岁,图a、b、c分别为A、B、C组图像,显示动脉期胰腺内分泌肿瘤的显示情况(箭头)。图2c为靶重建和IMR重建图像,图像质量最佳,病变显示较图2a和图2b清晰。
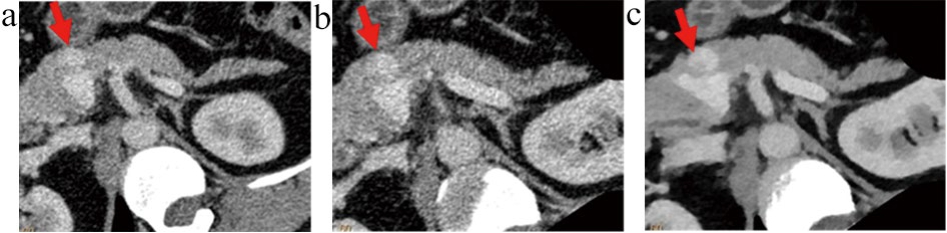
图3 患者2靶重建和IMR重建图像
注:患者女,63岁,图a、b、c分别为A、B、C组图像,显示静脉期胰腺内分泌肿瘤的显示情况(箭头)。图3c为靶重建和IMR重建图像,图像质量最佳,病变轮廓清晰对比度最佳,显示较图3a和图3b清晰。
2名医师对3组图像质量评分一致性较好,Kappa值为0.85。3组图像质量主观评分,见表3。其中A组和B组比较,图像质量评价1分的率的比较χ2=1.7,没有明显差异性P>0.05。而C组图像质量1分的评价较B组率的比较χ2=9.2,有统计差异性P<0.05。
表3 三组图像质量主观评分结果 [例 (%)]
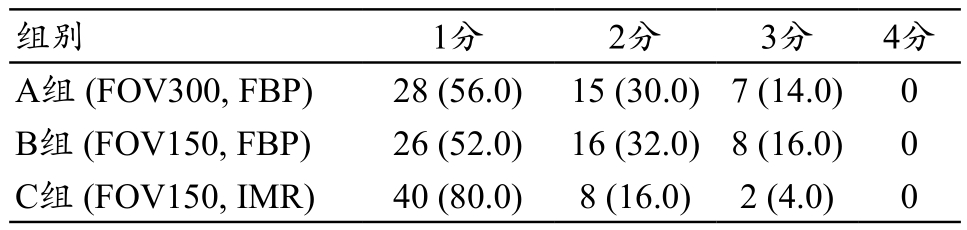
images/BZ_11_236_1520_1185_1574.pngA组 (FOV300, FBP) 28 (56.0) 15 (30.0)7 (14.0) 0 B组 (FOV150, FBP) 26 (52.0) 16 (32.0)8 (16.0) 0 C组 (FOV150, IMR) 40 (80.0) 8 (16.0) 2 (4.0) 0
3 讨论
目前,增强CT已经成为胰腺病变的重要检查手段之一[8-9],其具有很高的空间分辨率和密度分辨率,可以给胰腺病变提供清晰的病灶细节和血供特征,使诊断精确度达到很高的水平[10]。然而,胰腺形态偏小,并且病理状态下体积导致变化,肿瘤和急性胰腺炎会引起胰腺体积弥漫性肿大而掩盖病变,慢性胰腺炎和肿瘤则引起胰腺体积缩小导致病变不利于观察[7,11]。本研究通过靶重建技术和IMR重建技术探讨提高图像质量,更清晰显示胰腺病变。
随着设备及后处理技术的不断发展,靶重建技术已经成为小器官或者小病变特有的提高图像质量的方法。矩阵不变,重建FOV越小影像细节越丰富,图像的分辨率越高。和常规局部放大的图像相比靶重建能清晰显示病症的形态、密度、边界、内部细节。尤其在胸部肺结节检查[12]和颞骨听骨链三维重建中已经广泛应用[13],并具有重要的临床价值。本研究通过对胰腺的靶重建中发现,胰腺的形态放大,影像细节更加丰富,有利于病变的发现。但靶重建后主观评价发现图像噪声增加,这也和理论上相对应,空间分辨率提高了噪声会适当增加。其中A和B组的统计数据结果表明靶重建(B组)图像重建后FOV变小,而矩阵没有变化,图像分辨率提高,可视化也得到改善,影像细节增加,利于病变的观察。从本组数据的主管评分结果显示,B组图像质量1分的评分概率明显增加,图像细节显示优于A组。但图像噪声较A组有所增加,但变化不是很明显,没有统计学上的差异性。
全模型迭代重建技术(Iterative Model Reconstruction Algorithm,IMR)是最新一代的迭代重建技术算法,结合了三维微平板探测器和多模型重组算法的完全迭代重组算法,可在重组的过程中准确建立数据统计模型和图像统计模型,并且通过反复减少扫描模型与采集数据间的差异来显示图像,比混合迭代重建技术降低图像噪声、提高图像密度分辨率和空间分辨率的能力更强[14]。已有研究报道,IMR与传统FBP重建相比,降低了80%左右的噪声,并提高了43%~80%的密度分辨率[15-16]。在腹部CT成像中IMR重建可以明显降低图像噪声,提高密度分辨率,改善图像锐利度,尤其在薄层重建中更能体现IMR的优势。本研究数据显示IMR重建技术确实明显降低图像噪声,主观图像质量评价非常高,为胰腺病变的检出,病变边界,范围,组织细节提供了非常好的帮助。
综上所述,靶重建技术和IMR重建技术能明显降低胰腺图像噪声,提高胰腺图像质量,增强医师主观评价的综合诊断信心,对清晰显示胰腺病灶有一定的意义。
[1]Granata V,Fusco R,Catalano O,et al.Multidetector computer tomography in the pancreatic adenocarcinoma assessment: an update[J].Infect Agent Cancer,2016,11(1):1-7.
[2]Holm J,Loizou L,Albiin N,et al.Low tube voltage CT for improved detection of pancreatic cancer: detection threshold for small, simulated lesions[J].BMC Med Imaging,2012,12(1):1-9.
[3]Djuric-Stefanovic A,Masulovic D,Kostic J,et al.CT volumetry of normal pancreas: correlation with the pancreatic diameters measurable by the cross-sectional imaging, and relationship with the gender, age, and body constitution[J].Surg Radiol Anat,2012,34(9):811-817.
[4]刘翠芳,赵建农,余聪,等.多层螺旋CT测量胰腺体积的准确性评价[J].临床放射学杂志,2012,31(5):663-666.
[5]Miriam Klauß,Max Schöbinger,Ivo Wolf,et al.Value of threedimensional reconstructions in pancreatic carcinoma using multidetector CT: Initial results[J].World J Gastroentero,2009,15(46):5827-5832.
[6]Frellesen C,Fessler F,Hardie AD,et al.Dual-energy CT of the pancreas: improved carcinoma-to-pancreas contrast with a noise-optimized monoenergetic reconstruction algorithm[J].Eur J Radiol,2015,84(11):2052-2058.
[7]王慧慧,刘婧,刘建新,等.双能量CT非线性融合技术对胰腺占位显示的初步研究[J].临床放射学杂志,2017,36(8):1195-1198.
[8]Sinha A,Singh VK,Cruise M,et al.Abdominal CT predictictors of fibrosis in patients with chronic pancreatitis undergoing surgery[J].Eur Radiol,2015,25(5):1339-1346.
[9]解骞,梁宗辉.胰腺CT灌注成像的研究进展[J].CT理论与应用研究,2014,23(1):184.
[10]Kim DW,Kim HJ,Kim KW,et al.Neuroendocrine neoplasms of the pancreas at dynamic enhanced CT: comparison between grade 3 neuroendocrine carcinoma and grade 1/2 neuroendocrine tumor[J].Eur Radiol,2014,25(5):1375-1383.
[11]Djuric-Stefanovic A,Masulovie D,Kostic J,et al.CT volumetry of normal pancreas: correlation with the pancreatic diameters measurable by the cross-sectional imaging,and relationship with the gender, age, and body constitution[J].Surg Radinl Anat,2012,34(9):811-817.
[12]赵红,齐银萍,陈俊波.UHRCT靶扫描重建在超细支气管镜肺外周结节检查中的应用[J].医学影像学杂志,2015,25(5) :934-936.
[13]Labriet H,Nemoz C,Renier M,et al.Significant dose reduction using synchrotron radiation computed tomography: first clinical case and application to high resolution CT exams[J].Sci Rep,2018,8(1):12491-12497.
[14]Ryu YJ,Choi YH,Cheon JE,et al.Knowledgebased iterative model reconstruction Comparative image quality and radiation dose with a pediatric computed tomography phantom[J].Pediatr Radiol,2016,46(3):303-315.
[15]Mehta D,Thompson R,Morton T,et al.Iterative model reconstruction: simultaneously lowered computed tomography radiation dose and improved image quality[J].Med Phys Int,2013,1(2):147-155.
[16]Suzuki S,Haruyama T,Morita H,et al.Initial performance evaluation of iterative model reconstruction in abdominal computed tomography[J].J Comput Assist Tomo,2014,38(3):408-414.
Effects of Target Reconstruction and IMR on Image Quality of Pancreatic CT