前列腺良恶性病变超声造影参数与VEGF、TGF-β1相关性的初步研究
引言
近年来,前列腺癌的发病率在我国呈逐年上升趋势,严重影响老年男性的身心健康。在前列腺肿瘤的发生和发展中血管生成起着至关重要的作用[1]。超声造影(Contrast Enhanced Ultrasound,CEUS)技术可以显示前列腺血管的血流灌注,能够反映前列腺毛细血管及微循环,有文献报道经直肠超声造影能够使前列腺癌的检出率得以提高[2-5]。血管内皮生长因子(Vascular Endothelial Groth Factor,VEGF)是重要的促血管生成因子,与健康的个体相比,前列腺癌患者的组织和血清中VEGF水平更高[6]。转化生长因子(Transforming Growth Factor Beta 1,TGF-β1)能促进前列腺癌血管生成,是前列腺癌侵袭性形成的重要因素[7]。本文旨在研究前列腺良恶性病变超声造影参数与血清VEGF、TGF-β1值的相关性,对前列腺癌的临床诊断及治疗提供帮助。
1 材料与方法
1.1 临床资料
2015年9月至2017年12月间我院泌尿外科收治的前列腺特异性抗原>4 ng/mL(包括TPSA>100 ng/mL的患者)或前列腺CT或MRI检查可疑前列腺癌患者118例,年龄43~85岁,平均68岁,血清TPSA水平4.34~100 ng/mL,平均19.41 ng/mL。排除患有严重心、肺疾病等造影禁忌症的患者,排除同时患有其他恶性肿瘤的患者。所有研究对象均在两周内未进行前列腺按摩、直肠指诊等刺激性检查,空腹采静脉血,离心后取血清,用酶标记免疫吸附测定法测定血清VEGF值、TGF-β1值,且均行经直肠前列腺超声造影检查及超声引导下前列腺穿刺活检,对于超声造影无异常增强区域的患者采用12针系统穿刺活检法,有异常增强区域者加穿1~2针。
1.2 仪器与方法
1.2.1 仪器
采用美国飞利浦公司生产的IU22型彩色多普勒超声诊断仪,5~10 MHz变频经直肠端扫式探头,配经直肠专用穿刺架,18G活检针(长20 cm)及自动活检枪(由Bard公司生产),机械指数设为0.11~0.13。超声造影剂采用意大利Barcco公司生产的注射用六氟化硫微泡(声诺维SonoVue)、VEGF及TGF-β1血清检测试剂盒。
1.2.2 方法
静脉穿刺采集全血,待其凝血,室温下离心获取血清,用ELISA法测定患者血清中VEGF、TGF-β1含量。患者左侧膝胸卧位,行经直肠前列腺扫查及超声造影检查,储存图像并实时观察前列腺内造影剂的整体增强情况,造影观察时间均为3 min,用QLAB软件分析前列腺正中最大切面外腺及内腺左右侧各2点共4点或结节切面外腺及内腺4点(包含结节)的时间-强度曲线形态,拟合曲线后记录定量参数,即上升时间(RT)、峰值强度(PI)、平均通过时间(MTT)、曲线下面积(AUC)、强度降半时间(IHT)、上升支斜率(WIS)、达峰时间(TTP),求取各个病例4点相应参数的平均值。
最后行超声引导下经直肠前列腺穿刺活检术,用18G穿刺针分别在左右叶底、中、尖进行12针系统穿刺活检,针对造影所显示异常增强区域加穿1~2针。
1.2.3 统计学分析
采用SPSS 21.0统计软件进行分析,计量资料以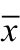 ±s描述,前列腺良性病变组与前列腺恶性病变组患者各项指标比较采用Wilcoxon秩和检验,指标间相关分析采用Spearman秩相关检验。检验水准=0.05,P<0.05为具有统计学意义。
±s描述,前列腺良性病变组与前列腺恶性病变组患者各项指标比较采用Wilcoxon秩和检验,指标间相关分析采用Spearman秩相关检验。检验水准=0.05,P<0.05为具有统计学意义。
2 结果
2.1 前列腺穿刺病理结果
经直肠前列腺组织穿刺病理结果显示:118例患者中良性前列腺增生60例,前列腺腺癌52例,前列腺慢性肉芽肿性炎3例,前列腺脓肿2例,前列腺孤立性纤维瘤1例。前列腺慢性肉芽肿性炎、前列腺脓肿、前列腺孤立性纤维瘤共6例,例数过少,在统计中剔除,112例良性前列腺增生及前列腺癌患者纳入研究。
2.2 前列腺良恶性病变经直肠超声造影增强模式经直肠超声造影参数比较
本组60例良性前列腺增生患者超声造影多表现为前列腺组织内造影剂缓慢均匀填充,内腺造影剂进入早于外腺,内腺的增强强度高于外腺,造影剂缓慢消退,且内腺廓清时间晚于外腺(图1)。本组52例前列腺癌患者,23例表现为弥漫性增强,即前列腺组织整体呈弥漫均匀增强,内外腺分界不清,造影剂快速进入,快速消退(图2);26例表现为不均匀增强,即前列腺组织整体呈弥漫不均匀增强,内外腺分界不清,造影剂快速进入,快速消退(图3);3例表现为局灶性(结节性)增强,即前列腺局部区域呈高增强,造影剂快速进入,快速消退(图4~5)。在RT、PI、MTT、AUC、IHT、WIS、TTP 7个超声造影参数中,RT、PI、MTT、AUC、WIS、TTP 6个超声造影参数在良性病变组和恶性病变组间比较差异有统计学意义(P<0.01)。恶性病变组PI、AUC、WIS较良性病变组高(P<0.01),而RT、MTT、TTP较良性病变组短(P<0.01)(表1)。
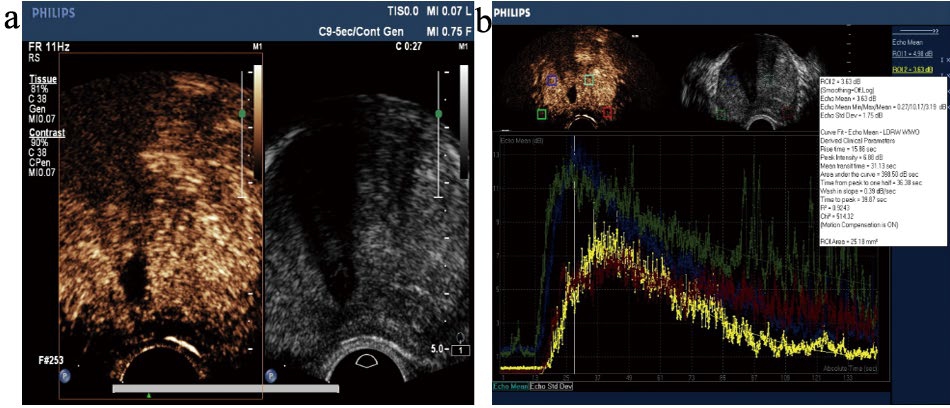
图1 良性前列腺增生患者超声造影均匀性增强
注:a. 良性前列腺增生超声造影呈均匀性增强;b. 超声造影时间-强度曲线(缓升缓降)及参数。
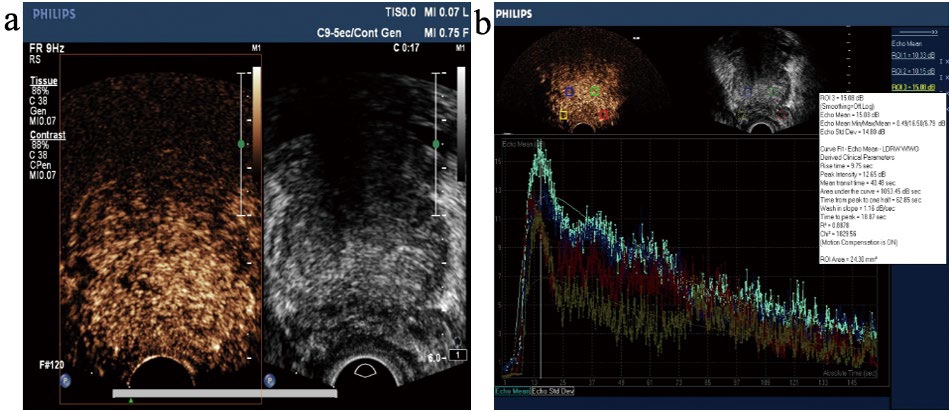
图2 前列腺癌患者超声造影弥漫性增强
注:a. 前列腺癌超声造影呈弥漫性增强;b. 超声造影时间-强度曲线(速升速降)及参数。
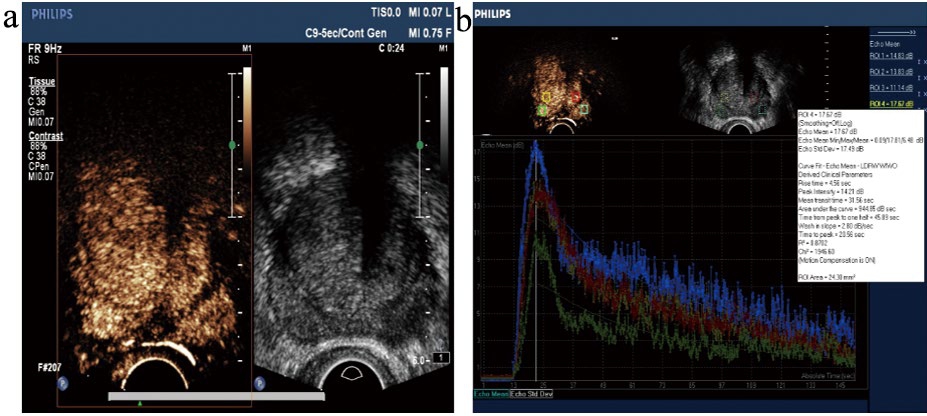
图3 前列腺癌超声造影不均匀性增强
注:a. 前列腺癌超声造影呈不均匀性增强;b. 超声造影时间-强度曲线(速升速降)及参数。
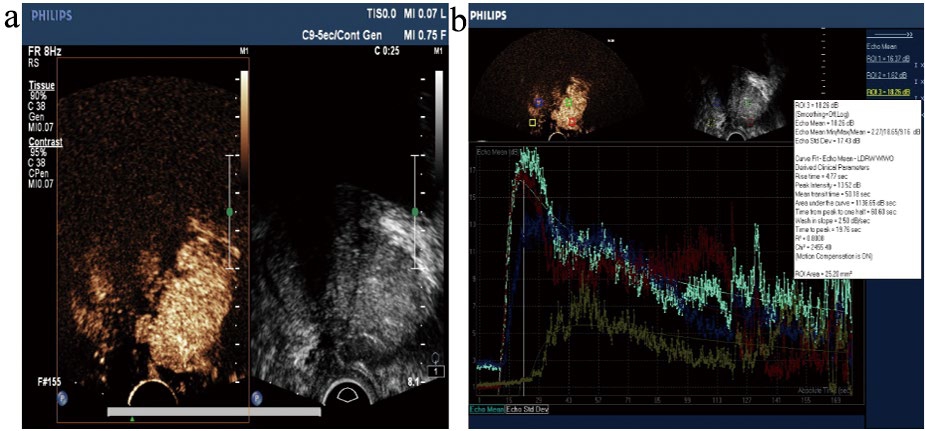
图4 前列腺癌超声造影局灶性增强
注:a. 前列腺癌超声造影呈局灶性增强;b. 超声造影时间-强度曲线(速升速降)及参数。
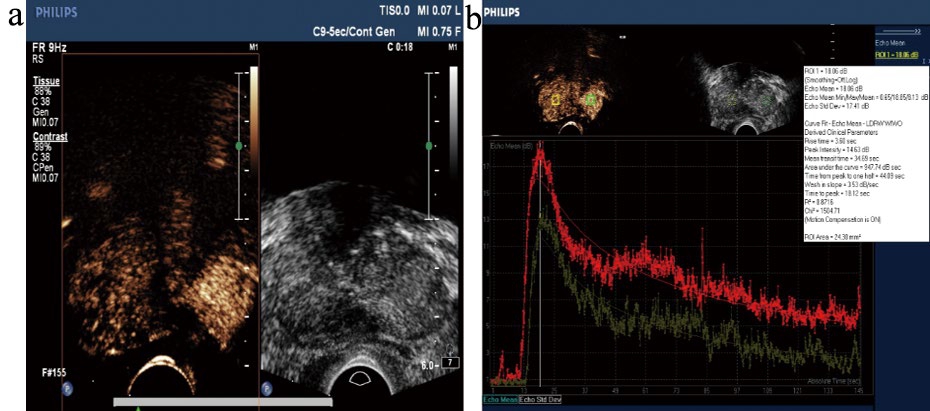
图5 前列腺癌超声造影结节性增强
注:a. 前列腺癌超声造影呈结节性增强;b. 超声造影时间-强度曲线(速升速降)及参数。
2.3 前列腺良恶性病变血清VEGF及TGF-β1值比较
良性病变组、恶性病变组血清VEGF及TGF-β1值比较差异有统计学意义(P<0.01),良性病变组血清VEGF及TGF-β1值低,恶性病变组血清VEGF及TGF-β1值高(表2)。
表2 前列腺良性病变与前列腺恶性病变血清VEGF及TGF-β1值比较(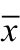 ±s)
±s)

注:采用Wilcoxon秩和检验,*P<0.01。
血清值 前列腺增生 前列腺癌 统计量 P VEGF (pg/mL) 25.26±24.09 35.57±33.52 2.861 0.004*TGF-β1 (ng/mL)33.70±22.30 57.85±36.14 5.382 <0.001*
2.4 前列腺良恶性病变超声造影参数与血清VEGF及TGF-β1值相关性分析
参数PI与血清VEGF值呈显著正相关,参数 WIS与血清VEGF值呈显著正相关,参数TTP与血清VEGF值呈负相关,参数RT、MTT、AUC、IHT与血清VEGF值无明确相关关系(表3);参数RT与血清TGF-β1值呈负相关,参数PI与血清TGF-β1值呈显著正相关,参数AUC与血清TGF-β1值呈显著正相关,参数WIS与血清TGF-β1值呈显著正相关,参数MTT、IHT、TTP与血清TGF-β1值无明确相关关系(表4)。
3 讨论
血管生成和肿瘤生长密切相关[8]。经直肠超声造影对于肿瘤血管生成成像尤其有意义,因为它能够突出前列腺微血管中的低速血流,能较为客观地反映前列腺组织血流灌注情况,这种能力是由超声造影剂实现的,由于其由气体微泡填充,且大小与红细胞相似,故可以流经最小的微血管,只在血管中停留几分钟,不外渗到组织间隙,更适合于血流动力学的定量[9],这种定量方法是通过时间-强度(TIC)曲线实现的,从TIC曲线中提取超声造影参数,可以定量分析前列腺肿瘤的血管生成和组织学特性,对于提高前列腺穿刺活检阳性率及病变检出率有积极的意义。前列腺癌的发生发展过程中有多种因子参与。目前已知的促血管因子中VEGF是作用最强的因子之一,其通过与血管内皮生长因子受体结合发挥作用,可刺激前列腺血管内皮细胞增殖、促进前列腺癌组织转移,VEGF通过自分泌和旁分泌两种途径刺激肿瘤细胞的生长和间质新生血管的形成[10]。TGF-β1也能够促进前列腺癌血管生成,通过刺激癌周细胞、血管平滑肌细胞增殖和分化,使血管结构成为稳定成熟的血管床,进而促进肿瘤血管增生、肿瘤细胞侵袭转移[11]。
表1 前列腺良性病变与前列腺恶性病变超声造影参数比较(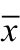 ±s)
±s)

注:采用Wilcoxon秩和检验,*P<0.01。
参数 前列腺增生 前列腺癌 统计量 P RT (s) 11.45±11.44 6.11±3.61 5.385 <0.001*PI (dB) 4.54±3.32 10.12±3.93 7.333 <0.001*MTT (s) 33.29±20.24 26.47±15.12 3.447 <0.001*AUC (dBs) 294.57±307.03 568.11±377.71 4.422 <0.001*IHT (s) 45.65±34.85 40.49±26.1 1.765 0.077 WIS (dB/s) 0.35±0.52 1.48±0.87 7.39 <0.001*TTP (s) 30.21±16.05 23.95±0.49 5.102 <0.001*
表3 前列腺良恶性病变超声造影参数与血清VEGF值相关性分析

注:*P<0.05。
VEGF RT (s) PI (dB) MTT (s) AUC (dBs) IHT (s ) WIS (dB/s ) TTP (s )r-0.177 0.216 -0.16 0.126 -0.118 0.246 -0.191 P 0.055 0.019* 0.083 0.174 0.201 0.007* 0.039*
表4 前列腺良恶性病变超声造影参数与血清TGF-β1值相关性分析

注:*P<0.05。
TGF-β1值 RT (s) PI (dB) MTT (s) AUC (dBs) IHT (s ) WIS (dB/s ) TTP (s )r-0.187 0.419 -0.127 0.228 -0.034 0.374 -0.16 P 0.043* <0.001* 0.17 0.013* 0.718 <0.001* 0.084
本组60例良性前列腺增生患者超声造影多表现为前列腺组织缓慢均匀增强,这是由于增生的前列腺血管分布均匀,血管直且分支规则,不存在动静脉分流及动静脉瘘,故造影剂灌注均匀且流进流出缓慢;内腺增强时间早于外腺且增强强度高于外腺,这与前列腺增生主要以内腺增生为主有关,内腺在增生过程中需要大量新生血管,但这些血管通常都是正常血管,具有完整的血管结构,因此内腺血流灌注较外腺增加且灌注均匀、消退缓慢;52例前列腺癌患者,有23例超声造影增强模式表现为整体弥漫性增强,26例表现为不均匀增强,3例表现为局灶性(结节性)增强,造影剂均快速增强、快速消退,这是由于前列腺肿瘤血管分布不同,造影剂微泡聚集的形式也不同而造成的,肿瘤微血管在结构上和功能上都与正常血管不同,肿瘤微血管通常呈不规则的分支,缺乏正常的树枝状分布结构,迂曲扩张、粗细不均,具有不可预测的血管直径,高的弯曲度,多见粗大的毛细血管和窦状间隙,并包含动静脉分流[12],故造影剂灌注可能不均匀、也可能均匀,且流进流出速度较快。对这112例前列腺良恶性病变超声造影TIC曲线拟合得出的7个造影参数中有6个参数(RT、PI、MTT、AUC、WIS、TTP)良恶性比较差异有统计学意义(P<0.01)。恶性病变组RT、MTT、TTP明显短于良性病变组,与肿瘤微血管的快速生长,血管网杂乱无章,血流不规则灌注有关;PI表现为恶性_病变组大于良性病变组,说明恶性病变组的微血管密度及组织的血流量大于良性病变组,与吴成爱等[13]的研究结果一致;AUC表现为恶性病变组大于良性病变组,单位时间内造影剂流入量明显多于良性病变组,可能与前列腺肿瘤内微循环明显增加、局部形成动静脉分流及动静脉瘘、血管内血流量增多有关,与陆殿元等[14]的研究结果一致;WIS表现为恶性病变组大于良性病变组,可能是由于恶性病变组造影曲线的PI高于良性病变组,且TTP、RT短于良性病变组所致,曲线呈速升型,造影剂流进速度快,与肿瘤组织大量新生血管、存在动静脉短路且血管内血流速度增快有关。
本研究中前列腺恶性病变患者血清VEGF值高于前列腺良性病变组,是由于在前列腺癌中,VEGF主要位于前列腺癌细胞以及血管内皮细胞,而在前列腺增生中,VEGF主要位于腺上皮细胞和血管内皮细胞,因血管内皮细胞本身不产生VEGF,故前列腺癌中大量的VEGF主要来源于前列腺癌细胞,在前列腺癌细胞增殖分化和浸润转移的过程中,癌细胞分泌大量的VEGF进入血液,造成前列腺恶性病变患者血清中VEGF浓度较前列腺良性病变组升高[15]。TGF-β1在前列腺癌患者血清中增高,与Baselga等[16]的研究结果一致,TGF-β1可促进前列腺癌细胞的增殖分化、增强前列腺癌的侵袭能力,其参与前列腺癌发病的主要机制是通过参与细胞周期和凋亡的调控,促进细胞外基质的增殖和肿瘤血管的生成[17]。
另外,将经直肠前列腺超声造影参数与良、恶性病变组血清VEGF值、TGF-β1值进行Spearman相关分析发现:PI与血清VEGF值呈显著正相关,即血清VEGF值越高,PI越高;WIS与血清VEGF值呈显著正相关,即血清VEGF值越高,WIS越高;TTP与血清VEGF值呈负相关,即血清VEGF值越高,TTP越短;RT与血清TGF-β1值呈负相关,即血清TGF-β1值越高,RT越短;PI与血清TGF-β1值呈显著正相关,即血清TGF-β1值越高,PI越高;AUC与血清TGF-β1值呈显著正相关,即血清TGF-β1值越高,AUC越大;WIS与血清TGF-β1值呈显著正相关,即血清TGF-β1值越高,WIS越高。
血清VEGF及TGF-β1与前列腺癌血管生成关系密切,且造影参数 PI、WIS、TTP、RT、AUC 与血清 VEGF、TGF-β1具有相关性,故超声造影参数能够反映前列腺癌的血管生成,可用于指导前列腺靶向穿刺活检,以提高前列腺癌的检出率。本研究的不足之处为超声造影只选取一个平面,由于前列腺癌的多灶性容易造成其他平面病灶漏诊,下一步将进一步研究前列腺三维超声造影以弥补这一不足。
4 结论
超声造影参数能够反映前列腺癌的血管生成,可用于指导前列腺靶向穿刺活检;血清VEGF值、TGF-β1值能够反映前列腺癌的生物学行为,对前列腺癌治疗及疗效评估有一定的价值。
[1] Hulsurkar M,Li Z,Zhang Y,et al.Beta-adrenergic signaling promotes tumor angiogenesis and prostate cancer progression through HDAC2-mediated suppression of thrombospondin-1[J].Oncogene,2017,36(11).
[2] Van Hove A ,Savoie P-H ,Maurin C,et al.Comparison of imageguided targeted biopsies versus systematic randomized biopsies in the detection of prostate cancer: a systematic literature review of well-designed studies[J].World J Urol,2014,32:847-858.
[3] 朱云开,陈亚青,蒋珺,等.经直肠超声造影靶向穿刺在前列腺癌检测中的作用:与系统穿刺方案的对比研究[J].中华超声影像学杂志,2014,23(11):970-974.
[4] 龚继军,张蒂荣,薛敏,等.经直肠超声造影在前列腺癌诊断中的临床应用价值探讨[J].中国医药科学,2017,7(13):127-129.
[5] Mannaerts CK,Wildeboer RR,Postema AW,et al.Multiparametric ultrasound: evaluation of greyscale, shear wave elastography and contrast-enhanced ultrasound for prostate cancer detection and localization in correlation to radical prostatectomy specimens[J].BMC Urol,2018,18(1):98.
[6] Liu ZQ,Fang JM,Xiao YY,et al.Prognostic role of vascular endothelial growth factor in prostate cancer: A systematic review and meta-analysis[J].Int J Clin Exp Med,2015,8:2289-2298.
[7] Wu CT,Hsieh CC,Yen TC,et al.TGF-β1 mediates the radiation response of prostate cancer[J].JMM,2015,93(1):73-82.
[8] Prager GW,Poettler M.Angiogenesis in cancer[J].Hämostaseologie,2012,32(2):105-114.
[9] Heydarheydari S,Dehlaghi V,Haghparast A.The applications of ultrasound microbubbles in molecular diagnosis and therapy[J].Acta Medica Iranica,2016,54(5):343.
[10] Liu L,Liang Z,Guo K,et al.Relationship between the expression of CD133, HIF-1α, VEGF and the proliferation and apoptosis in hypoxic human prostate cancer cells[J].Oncol Lett,2017,14(4):4065-4068.
[11] Kimbrough-Allah MN,Millena AC,Khan SA.Differential role of PTEN in transforming growth factor β (TGF-β) effects on proliferation and migration in prostate cancer cells[J].Prostate,2018,78(5):377-389.
[12] Russo G,Mischi M,Scheepens W,et al.Angiogenesis in prostate cancer: onset, progression and imaging[J].BJU Int,2013,110(11c):E794-E808.
[13] 吴成爱,刘聪雅,杨永生,等.前列腺癌经直肠超声造影定量参数及分化程度与微血管密度相关性的初步研究[J].中华超声影像学杂志,2015,24(10):865-868.
[14] 陆殿元,沈理,蔡建荣,等.超声造影时间-强度曲线诊断前列腺癌[J].中国医学影像技术,2015,31(8):1255-1258.
[15] Huang YL,Lin YC,Lin CC,et al.High Glucose induces VEGF-C expression via the LPA1/3-Akt-ROS-LEDGF signaling axis in human prostate cancer PC-3 Cells[J].Cell Physiol Biochem,2018,50(2):597-611.
[16] Baselga J,Rothenberg ML,Tabernero J,et al.TGF-beta signalling-related markers in cancer patients with bone metastasis[J].Biomarkers,2008,13(2):217-236.
[17] Paller C,Pu H,Begemann DE,et al.TGF-β receptor I inhibitor enhances response to enzalutamide in a pre-clinical model of advanced prostate cancer[J].Prostate,2019,79(1):31-43.
Preliminary Study on the Relationship Between the Parameters of Contrast-Enhanced Ultrasound and VEGF & TGF-β1 in Benign and Malignant Lesions of Prostate