靶向VEGF165多模态分子成像探针制备与体内外靶向成像研究
引言
肿瘤血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)是维持肿瘤血管生长和增殖的关键生长因子,广泛存在于恶性肿瘤中,分布于肿瘤细胞和肿瘤邻近血管内皮细胞的胞浆内外,通过细胞膜上受体发挥作用。VEGF165是体内最多的亚型,其生物活性最强,故在临床和科研中应用最多[1]。VEGF165能直接刺激肿瘤细胞增殖,促进肿瘤的血管生成及转移,其表达水平与肿瘤的恶性程度呈正相关,使得VEGF165成为重要的肿瘤显像与治疗靶分子。适配体(Aptamer)是具有特异性蛋白结合功能的单链寡核苷酸片段,VEGF165-Aptamer是可特异性识别和结合VEGF165的适配体,其序列由27个碱基组成[2]。由于其结构灵活易变,三维构象复杂,很容易形成与靶标结合的口袋结构,所以理论上能与VEGF165靶分子结合。CY5.5的发光在近红外区,背景非常低,易于标记蛋白质、适配体等靶向物质,特别适合于活体小动物体内成像研究。
Lim等[3]将αvβ3-Aptamer与超顺磁性氧化铁(Ultrasmall Superparamagnetic Iron Oxide,USPIO)连接构建 Apt αvβ3-MNPs磁性纳米粒,对肝癌小鼠模型显示出较好的T2负性强化效果。Fan等[4]用人类表皮成长因子受体2(Human Epidermal Growth Factor Receptor 2,HER2)特异性CY3-Aptamer标记USPIO,从SK-BR-3乳腺癌患者血中成功分离出乳腺癌细胞,并被荧光及MRI成像证实。Wu等[5]将前列腺癌膜抗原PSMA特异性Aptamer与USPIO连接,体外对前列腺癌PC3细胞显示出明显的T2负性靶向强化作用。Cui等[6]合成RGD-PAA-USPIO,对鼻咽癌移植瘤抗血管生成治疗效果监测,治疗后4天与14天,实验组观察到肿瘤T2负性靶向强化,随着时间延长,肿瘤缩小,而对照组T2负性强化不明显。我们采用化学交联法将USPIO与CY5.5-VEGF165-Aptamer进行化学交联,得到靶向性磁性纳米微粒CY5.5-VEGF165-Aptamer-USPIO,并进行活体内外靶向实验,与上述实验相比,我们选用的靶点VEGF165在活体内肿瘤分布更广泛,VEGF165-Aptamer分子量更小,体内无免疫源性,因此本靶向对比剂今后更有临床应用价值。本实验鉴定其理化性质,观察其体外对肿瘤VEGF165靶点的靶向结合能力,同时观察其体内MRI及荧光靶向肿瘤显像效果,为今后其携带阿霉素或多柔比星等化疗药用于肿瘤治疗奠定实验基础。
1 材料和方法
1.1 实验材料
CY5.5-VEGF165-Aptamer(由大连宝生物工程有限公 司 合 成 ),VEGF165(ProSpec-Tany TechnoGene Ltd),抗 -VEGF165(1:500-1000,Millipore Corporation),辣根过氧化物酶(HRP)标记羊抗兔IgG(1:500-1:2000,Millipore公司)。显色液A、B,终止液(英科新创科技有限公司),洗涤液为磷酸盐缓冲液(PBS,PH值为7.4),96孔酶标板(Sigma),酶标仪(Thermo Scientific Corporation,MK3型),USPIO(西北大学),EDC与NHS(Thermo Fisher Scientific Inc),普鲁氏蓝染色试剂盒(Solarbio),BEL-7402荷瘤鼠(上海斯莱克实验动物有限公司),3.0T MRI(GE),小动物荧光成像仪(IVIS Lumina II in vivo Imaging System)。
1.2 CY5.5-VEGF165-Aptamer-USPIO探针构建
取 1.5 mg USPIO(50 μL)加入 200 μL EDC(5 mg/mL)与200 μL NHS(5 mg/mL),37℃活化30 min;磁分离后向离心管中加入CY5.5-Aptamer 1 mg,PBS(pH=8.0)调整液体总体积500 μL,37℃避光偶联3 h;再次磁分离后加入1%甘氨酸封闭磁株,放入4℃冰箱备用。
1.3 CY5.5-Aptamer-USPIO与VEGF165体外结合能力的ELISA实验
实验分三组:空白对照组、实验组与阴性对照组。空白对照组5只2.5 mL离心管中放入0.25 mL CY5.5-USPIO,实验组与阴性对照组加入与之等量CY5.5-VEGF165-Aptamer-USPIO。将空白对照组与实验组加入相同量的VEGF165,阴性对照组加入与之等量VEGF121,37℃摇床内反应1 h;磁分离后每管内加入等量VEGF165一抗50 μL,37℃摇床内反应30 min;再次磁分离后每管内加入等量VEGF165二抗50 μL,37℃摇床内反应30 min;最后磁分离后每管内加入显色A液200 μL与B液200 μL,37℃摇床内反应10 min后每管内加入终止液200 μL,移液器从每管内吸出50 μL液体放入96孔酶标板中,450 nm测吸光度(Optical Density,OD)值,OD=l g(1/trans),其中trans为检测物的透光值。
1.4 CY5.5-VEGF165-Aptamer-USPIO体内靶向荧光成像实验
实验随机分两组,实验组与对照组。实验组与对照组均为8只腋下BEL-7402肝癌荷瘤鼠。实验组尾静脉注射CY5.5-VEGF165-Aptamer-USPIO 0.2 mL;对照组尾静脉给予CY5.5-USPIO 0.2 mL(与实验组等剂量、等摩尔浓度)。分别在注射对比剂后进行间断多时(1、2、3、4、6h)点扫描,检测每次成像采集的肿瘤荧光强度并进行记录,观察对比剂在肿瘤内的结合情况及代谢时间记录。在荧光强度峰值时间采集荧光成像后处死实验组2只、对照组1只荷瘤鼠,行免疫组化及普鲁氏蓝染色检查。
1.5 CY5.5-VEGF165-Aptamer-USPIO体内MRI靶向实验
实验随机分两组,实验组和对照组各8只腋下BEL-7402肝癌荷瘤鼠。扫描参数为轴位FSE T2WI:TR 400 ms,TE 102 ms;矩阵:192×192;FOV:8 cm×8 cm;层厚:0.8 mm;层间距:0。对比剂增强给药方式:麻醉方法,采用戊巴比妥1.0~1.25 mg/20~25 g,即0.05 mg/g(荷瘤鼠),每次扫描前10 min给药。实验组尾静脉注射CY5.5-VEGF165-Aptamer-USPIO 0.3 mL(1.5 mg/mL),对照组尾静脉注射等量CY5.5-USPIO。共扫描3次,分别在注射前平扫、注射后3 h与6 h扫描。信号强度的测量方法为分别在各时段同层面取三个感兴趣区(Region of Interest,ROI)求平均值,每个ROI直径约2.0 mm。
1.6 免疫组化
取肿瘤组织脱水、包埋、切片、脱蜡后,接着热修复。用pH=9.0柠檬酸缓冲液放在微波炉中火煮沸约10 min,然后自然冷却至室温;然后加VEGF165一抗1:4000,4℃过夜;取出玻片复温,从4℃冰箱内拿出玻片后复温10 min,PBS浸洗后加VEGF165二抗,37℃孵育30 min;最后PBS液浸洗三次后,使用DAB显色试剂盒的显色剂A、B各一滴,加至标本上,显色5~10 min,充分水洗后,苏木素复染细胞核1 min,再次充分水洗,待玻片干后,中性树脂封片。
1.7 普鲁氏蓝染色
取肿瘤组织脱水,包埋、切片、烤片、脱蜡,然后在玻片上滴加盐酸与亚铁氰化钾等量混合液染20~30 min,蒸馏水洗3遍;接着中性红溶液染1.5~2 min,自来水冲洗;最后脱水,二甲苯透明2 min两次,中性树脂封片。
1.8 统计学分析
用SPSS 17.0统计软件及Excel 2016进行数据统计分析,实验组与对照组均为计量资料,不同组间采用LSD-t检验进行两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 探针构建结果
CY5.5-VEGF165-Aptamer-USPIO构建示意图,见图1。CY5.5-VEGF165-Aptamer-USPIO粒径小于30 nm(图2),磁饱和度为35 emu/g(图3)。CY5.5-VEGF165-Aptamer-USPIO荧光发射光谱,见图4,其最大发射波峰在707 nm附近。

图1 USPIO经EDC与NHS活化后将CY5.5-VEGF165-Aptamer包被于其表面,构建成CY5.5-VEGF165-Aptamer-USPIO

图2 透射电镜示CY5.5-VEGF165-Aptamer-USPIO粒径小于30 nm
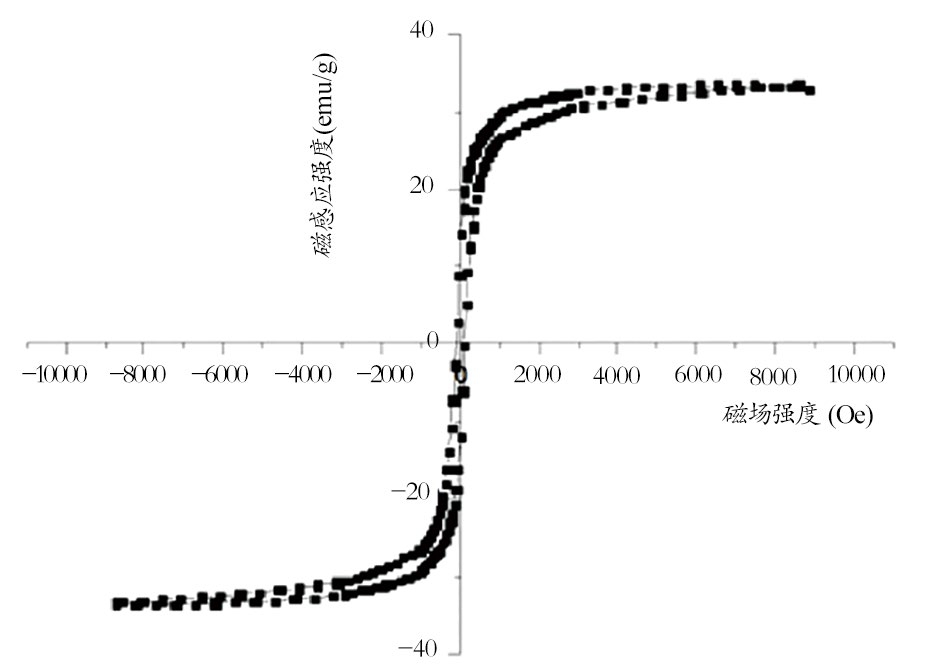
图3 CY5.5-VEGF165-Aptamer-USPIO饱和磁化强度

图4 CY5.5-VEGF165-Aptamer-USPIO磁性纳米颗粒水溶液的荧光发射光谱
2.2 CY5.5-VEGF165-Aptamer-USPIO体外与VEGF165体外结合实验研究实验结果
为确认与USPIO偶连的CY5.5-VEGF165-Aptamer能特异、高效地与VEGF165结合,我们设计了本ELISA实验。实验结果表明CY5.5-VEGF165-Aptamer仅能与VEGF165结合,而不能与VEGF121结合,USPIO没有与VEGF165结合的能力(见表1与图5)。
2.3 CY5.5-VEGF165-Aptamer-USPI体内靶向荧光实验
腋下肝癌实验组尾静脉注射CY5.5-VEGF165-Aptamer-USPIO后肿瘤荧光信号逐渐上升,3 h信号达最大值,然后信号逐渐下降,6 h接近平扫(图6)。对照组肿瘤未见明显荧光,未见明确强化。
表1 ELISA实验展示不同组在450 nm处获得的OD值 (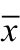 ±s)
±s)

注:本实验数据统计处理为LSD-t检验,F=474519.233,组间两两比较的统计结果显示P<0.05,差异有统计学意义。
组号 组名 OD值 统计学处理组比 P 1 空白对照 0.800±0.001 1:2 P<0.001 2 实验组 2.311±0.002 2:3 P<0.001 3 阴性对照组 0.803±0.004 1:3 P = 0.099
图5 CY5.5-VEGF165-Aptamer-USPIO体外与VEGF165体外结合ELISA实验
注:*实验组与空白对照组及阴性对照组P<0.05,差异有统计学意义。
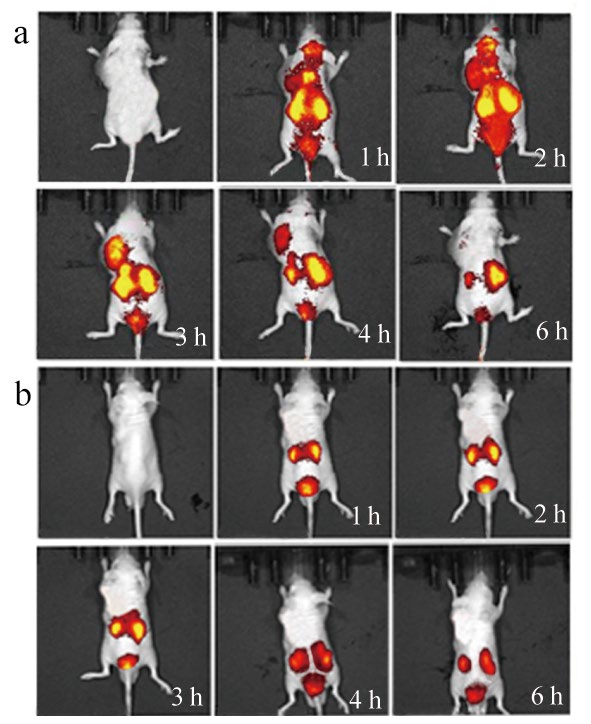
图6 CY5.5-VEGF165-Aptamer-USPIO活体荧光成像图
注:a.实验组 b.对照组。
2.4 CY5.5-VEGF165-Aptamer-USPIO体内靶向MRI实验
实验结果表明荷瘤鼠尾静脉注射CY5.5-VEGF165-Aptamer-USPIO后,在3 h T2WI上信号较平扫明显降低,6 h信号已经回升与平扫无显著差异;对照组鼠尾静脉注射CY5.5-USPIO后,不同时间点扫描,T2WI信号无明显差异(图7和图8)。免疫组化及普鲁氏蓝染色结果,见图9。肿瘤细胞浆VEGF165免疫组化染色阳性,呈棕黄色;部分肿瘤细胞浆见蓝色铁沉积,染色阳性。
3 讨论
利用Aptamer构建靶向探针是近年来颇受重视的一个研究方向,与抗体相比,核酸类配基更优越,如不受免疫条件和免疫原性限制,可体外人工合成,变性与复性可逆,可修饰并易于长期保存和室温运输[7-8]。利用酰胺键将CY5.5标记到VEGF165-Aptamer表面,合成时3'端带有一游离氨基供与羧基USPIO连接,其中Aptamer是一种小分子的寡核苷酸,其序列由27个碱基组成,序列结构特点是5'-CGGAAUCAGUGAAUGCUUA UACAUCCG-3',所有的嘧啶(C,U)为核糖环2'位被氟修饰(2'-F-C或2'-F-U),所有嘌呤(A,G)用核糖环2'位被甲基修饰(2'-O-CH3-A或2'-O-CH3-G),在自然环境下不被RNA酶降解。由于其结构灵活易变,三维构象复杂,很容易形成与靶标结合的口袋结构。其识别分子的模式与抗体类似,但比抗体具有更高的特异性,能识别VEGF165的肝素结合结构域[2]。

图7 CY5.5-VEGF165-Aptamer-USPIO活体MRI成像图
注:a.实验组 b.对照组

图8 CY5.5-VEGF165-Aptamer-USPIO SNR统计图
注:*实验组与对照组对比P<0.05,差异有统计学意义。
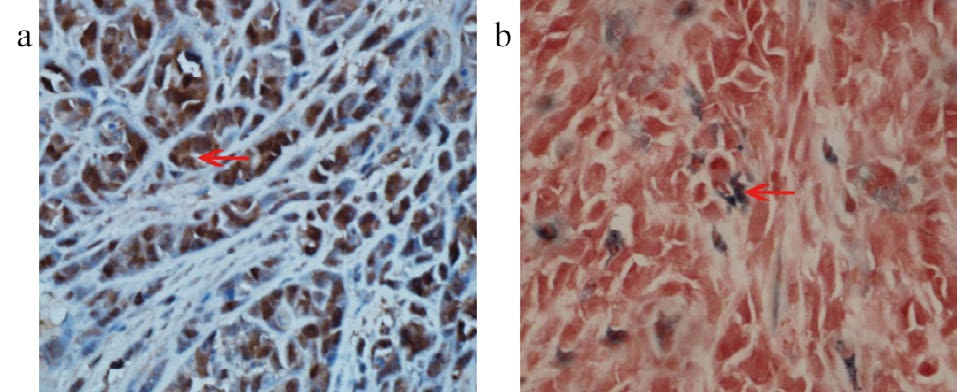
图9 免疫组化及普鲁氏蓝染色图
注:a. 免疫组化图,肿瘤细胞VEGF165染色呈阳性;b. 普鲁氏蓝染色图,部分肿瘤细胞内见阳性蓝色铁颗粒沉着。放大倍数× 400。
细胞高表达靶分子是分子成像的基础,由于VEGF165广泛分布于多种肿瘤细胞和肿瘤邻近血管内皮细胞的胞浆内外,通过细胞膜上VEGFR2受体发挥作用,促进血管内皮细胞增殖,提高血管的通透性,诱导新生血管的形成。肿瘤细胞不仅分泌VEGF165,同时还能表达其受体[9-10]。因此,VEGF165能直接刺激肿瘤细胞的增殖,但在生理情况下VEGF165表达水平很低,仅在胚胎组织与增殖期子宫内膜有适量的表达,因而是构建分子探针的理想靶点[11-12]。USPIO表面携带羧基,经EDC与NHS活化后可与CY5.5-Aptamer游离氨基反应,形成稳定连接体,成为靶向性对比剂合成基础[13-14]。
评价药物靶向投递系统的一个重要研究内容是分子探针对其病变部位的选择性,即靶向性[15]。靶向性使药物在活性部位有更高的浓度,从而降低药物剂量,减少毒副反应。为了检测CY5.5-VEGF165-Aptamer与VEGF165体外特异性结合能力,我们构建了ELISA实验,CY5.5-VEGF165-Aptamer-USPIO实验组与阴性对照组OD值差异有统计学意义,表明CY5.5-VEGF165-Aptamer-USPIO上连接的VEGF165-Aptamer只能与VEGF165结合而不能与生长因子VEGF121结合。由于空白对照组USPIO表面没有与VEGF165结合的对应物质,因此空白对照组与实验组OD值差异有统计学意义。这更进一步说明在我们设计的ELISA实验中,CY5.5-VEGF165-Aptamer-USPIO与VEGF165的结合是特异性靶向性的结合。为了验证CY5.5-VEGF165-Aptamer-USPIO在活体内对VEGF165的靶向性,我们建立了BEL-7402腋下荷瘤鼠模型,并分成实验组鼠尾静脉注射CY5.5-VEGF165-Aptamer-USPIO,对照组鼠尾静脉注射等量CY5.5-USPIO。体内荧光靶向实验显示,腋下肝癌实验组尾静脉注射CY5.5-VEGF165-Aptamer-USPIO后肿瘤荧光信号逐渐上升,表明CY5.5-VEGF165-Aptamer-USPIO逐渐积聚靶向BEL-7402肿瘤,3 h信号最大值,然后信号逐渐下降,6 h接近平扫,强化作用消失,对照组未见明显强化。MRI扫描发现实验组荷瘤鼠肿瘤在3 h T2WI信号较平扫明显降低,与荧光成像吻合,6 h T2WI信号已经回升与平扫无显著差异;对照组平扫、3 h、6 h各时间点T2WI信号变化不大;实验组肿瘤确实存在明显负性强化,并被普鲁氏蓝染色证实(图9)。肿瘤区VEGF165是我们靶向成像的靶点,其由肿瘤细胞分泌出胞外,经间质移向新生血管内皮细胞,刺激肿瘤新生血管形成及肿瘤细胞增殖(免疫组化证明瘤区VEGF165染色阳性,见图9),随着生物学功能完成而被解离代谢(动态过程)。实验组在3 h出现明显强化,说明此时CY5.5-VEGF165-Aptamer-USPIO已经与瘤区VEGF165靶点结合,6 h负性强化作用消失,说明此时与CY5.5-VEGF165-Aptamer-USPIO结合的VEGF165可能被代谢解离,与之结合的CY5.5-VEGF165-Aptamer-USPIO失去了这个游动的靶点,重新返回肿瘤血管进入体循环被代谢。对照组USPIO表面没有与VEGF165特意性结合的VEGF165-Aptamer,因此不可能与瘤区靶点结合,始终不存在强化效应。Huang等[16]合成anti-VEGF-conjugate@IO多功能靶向MRI探针,内结合Fe3O4及多柔比星抗癌药,表面标记VEGF抗体,靶向瘤区生长因子;尾静脉给药后1 h,腋下肝癌模型小鼠肿瘤出现T2负性强化,12 h强化达峰值,24 h瘤区仍见靶向负性强化存在。我们合成的靶向对比剂强化峰值在给药后3 h、6 h负性强化作用消失,与Huang等[16]的实验结果比,强化峰值时间较早,体内代谢较快,这可能与对比剂体内与靶点结合方式不同及对比剂粒径大小等特性有关。
综上所述,本研究结果显示通过化学方法构建CY5.5-VEGF165-Aptamer-USPIO多模态靶向分子探针,体外可靶向结合VEGF165,体内可以VEGF165为靶点靶向MRI及荧光显像;但活体内是否存在毒性及其大小,还需进一步实验证明。
[1] Chen CK,Yu WH,Cheng TY,et al.Inhibition of VEGF165/VEGFR2-dependent signaling by LECT2 suppresses hepatocellular carcinoma angiogenesis[J].Sci Rep,2016,6:31398.
[2] Lee JH,Canny MD,Erkenez AD,et al.A therapeutic aptamer inhibits angiogenesis by specifically targeting the heparin binding domain of VEGF165[J].Proc Natl Acad Sci USA,2005,102:(52):18902-18907.
[3] Lim EK,Kim B,Choi Y,et al.Aptamer-conjugated magnetic nanoparticles enable efficient targeted detection of integrin αvβ3 via magnetic resonance imaging[J].J Biomed Mater Res A,2014,120(1):49-59.
[4] Fan Z,Senapati D,Singh AK,et al.Theranostic magnetic coreplasmonic shell star shape nanoparticle for the isolation of targeted rare tumor cells from whole blood, fluorescence imaging and photothermal destruction of cancer[J].Mol Pharm,2013,10(3):857-866.
[5] Wu X,Ding B,Gao J,et al.Second-generation aptamerconjugated PSMA-targeted delivery system for prostate cancer therapy[J].Int J Nanomedicine,2011,6:1747-1756.
[6] Cui Y,Zhang C,Luo R,et al.Noninvasive monitoring of early antiangiogenic therapy response in human nasopharyngeal carcinoma xenograft model using MRI with RGD-conjugated ultrasmall superparamagnetic iron oxide nanoparticles[J].Int J Nanomedicine,2016,11:5671-5682.
[7] Sun P,Zhang N,Tang Y,et al.SL2B aptamer and folic acid dual-targeting DNA nanostructures for synergic biological effect with chemotherapy to combat colorectal cancer[J].Int J Nanomedicine,2017,12:2657-2672.
[8] Bai L,Chen Y,Bai Y,et al.Fullerene-doped polyaniline as new redox nanoprobe and catalyst in electrochemical aptasensor for ultrasensitive detection of Mycobacterium tuberculosis MPT64 antigen in human serum[J].Biomaterials,2017,133:11-19.
[9] Wang C, Zhang B,Lin Y,et al.Effects of adenovirus-mediated VEGF165 gene therapy on myocardial infarction[J].Ann Clin Lab Sci,2018,48(2):208-215.
[10] Sheng ZQ,Li YF,Zheng KL,et al.The relationship between number and function of EPCs and concentration of VEGF165 and SDF-1 in coronary artery spasm[J].Eur Rev Med Pharmacol Sci,2018,22(9):2767-2777.
[11] Fantin A,Lampropoulou A,Senatore V,et al.VEGF165-induced vascular permeability requires NRP1 for ABL-mediated SRC family kinase activation[J].J Exp Med,2017,214(4):1049-1064.
[12] Nguyen MT,Krupa M,Koo BK,et al.Correction: Prokaryotic soluble overexpression and purification of human VEGF165 by fusion to a maltose binding protein tag[J].PLoS One,2017,12(1):e0170602.
[13] Wang AZ,Bagalkot V,Vasilliou CC,et al.Superparamagnetic iron oxide nanoparticle-aptamer bioconjugates for combined prostate cancer imaging and therapy[J].Chem Med Chem,2008,3(9):1311-1315.
[14] Jin YH,Hua QF,Zheng JJ,et al.Diagnostic value of ER, PR, FR and HER-2-targeted molecular probes for magnetic resonance imaging in patients with breast cancer[J].Cell Physiol Biochem,2018,49(1):271-281.
[15] Skouras A,Papadia K,Mourtas S,et al.Multifunctional doxorubicin-loaded magnetoliposomes with active and magnetic targeting properties[J].Eur J Pharm Sci,2018,123:162-172.
[16] Huang H,Li Y,Li C,et al.A novel anti-VEGF targeting and MRI-visible smart drug delivery system for specific diagnosis and therapy of liver cancer[J].Macromol Biosci,2013,13(10):1358-68.
Preparation of VEGF165 Multimodal Molecular Imaging Probes and Its Targeting Imaging Studies in Vitro and in Vivo