基于MR的垂体空细胞腺瘤与其他垂体腺瘤鉴别的影像组学研究
引言
垂体腺瘤是一种较为常见的颅内肿瘤,约占10%~15%[1],随着影像学检查技术的不断进步,垂体腺瘤的检出率正在逐步增高[1-2]。2017年WHO垂体腺瘤分类强调了免疫组化结果在垂体腺瘤分类中的作用,垂体腺瘤可由此分为泌乳素瘤、生长激素腺瘤、促性腺激素腺瘤、促肾上腺皮质激素腺瘤、促甲状腺激素腺瘤、多激素腺瘤、空细胞腺瘤。其中空细胞腺瘤为较为特殊的无功能腺瘤,激素的免疫组化的结果均为阴性[3]。Diri等[4-5]研究发现,相比其他类型垂体腺瘤,放疗对于空细胞腺瘤的治疗最为有效,同时空细胞腺瘤也是复发率最低的病理类型。因此,术前预测垂体腺瘤的免疫学状态对于垂体空细胞腺瘤的诊断、个性化治疗以及预后评估具有重要的作用[6-7]。
MRI由于其具备优异的软组织分辨率,无辐射等优势,已经成为垂体腺瘤诊断或排除诊断的必要检查手段[8]。但常规的MR图像对于垂体腺瘤的分型诊断与鉴别并未能提供更多的帮助,血清学激素水平及临床症状的表现对于垂体腺瘤不同的亚型的诊断也具有一定的局限性。影像医学是人工智能与医学融合最为深入的领域,为人工智能在医学影像学的拓展应用,旨在从高通量的影像学图像中提取各种量化的特征值,继而得到肉眼无法获取的隐藏信息,最终服务于临床[9]。如今,影像组学研究已应用于肺癌[10],乳腺癌[11],肿瘤淋巴结转移[12]等多种疾病。笔者旨在探索运用MRI的影像组学方法鉴别空细胞腺瘤与其他类型垂体腺瘤,为垂体腺瘤的个性化、精准治疗及预后评估提供更多的帮助与参考。
1 资料与方法
1.1 一般资料
回顾性分析2013年1月至2018年5月吉林大学中日联谊医院符合以下标准的患者:经手术病理证实为垂体腺瘤;均有免疫组化结果;术前均进行MR平扫+增强扫描;排除图像质量不佳的患者;排除病灶过小(小于3 mm,影响纹理特征提取),最后共有182例纳入研究。
1.2 MR检查方法
(1)采用西门子3.0T skyra MR扫描仪。T1WI(TR:517 ms;TE:8.9 ms;FOV:180;层厚:2 mm);T2WI(TR:3500 ms;TE:94 ms;FOV:180;层厚:2 mm);CE-T1WI(TR:672 ms;TE:8.6 ms;FOV:180;层厚:2 mm)。
(2)3.0 T Philips Achieva MR扫描仪。T1WI(TR:506 ms;TE:12 ms;FOV:100;层厚:2.5 mm);T2WI(TR:2500 ms;TE:80 ms;FOV:100;层厚:2.5 mm);CE-T1WI(TR:575 ms;TE:10 ms;FOV:100;层厚:2.5 mm)。
(3)增强扫描造影剂:欧乃影15 mL。
1.3 图像分割及特征值提取
应用放射组学云平台(Huiying Medical Technology Co.Ltd.)进行病变特征值的提取,分别由两位放射科医师(诊断经验分别为5年和超过10年)对T1WI、T2WI以及CET1WI的冠状位图像进行病灶感兴趣区(VOIs)勾画及审核,继而完成图像的分割。利用影像组学云平台提取每个VOIs内的量化的1029个影像组学特征值。
1.4 模型建立及验证
利用Python(http://www.python.org/)软件建立影像组学模型。以4:1(145/37)的比例将数据集随机分为训练集与验证集。运用方差选择法(Variance threshold),方差分析(Analysis of variance)和最小绝对收缩和选择算法(the Least absolute shrinkage and selection operator,Lasso)提取训练集中与垂体免疫组化结果密切相关的有效特征值,并基于提取的特征值分别建立逻辑回归(LR)模型,最后利用验证集对预测模型进行验证。我们将比较T1WI、T2WI、CE-T1WI以及 T1WI&T2WI及 T1WI&T2WI&CE-T1WI的序列组合的预测结果以构建相对较好的预测模型。并在验证集中进行验证。受试者工作特征曲线(ROC曲线)及相关参数用来比较不同序列构建模型的效能。流程图,见图1。
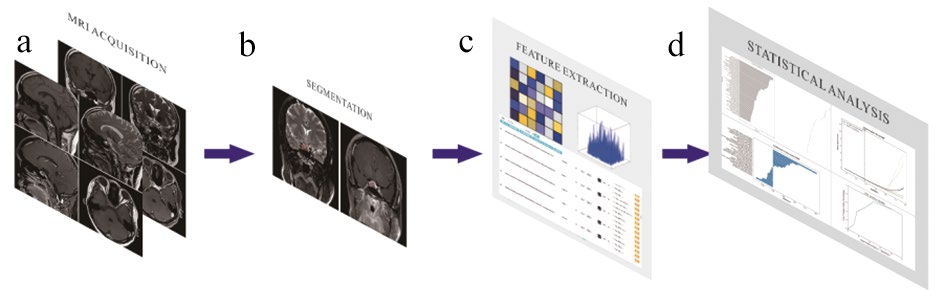
图1 影像组学模型建立的基本流程
注:a. 图像资料获取;b. 病变勾画分割;c. 特征值提取;d. 数据分析。
2 结果
我们共纳入182名病人,男性71人,女性111人,平均年龄为(50±13.66)岁,99例为空细胞腺瘤,其余83例为其他类型垂体腺瘤,其中泌乳素瘤27例,生长激素腺瘤15例,促性腺激素腺瘤20例,促肾上腺皮质激素腺瘤11例,多激素腺瘤10例。空细胞腺瘤与其他类型垂体腺瘤的平均体积分别为(7.71±8.80)cm³,(5.18±6.51)cm³(表 1)。
影像组学模型中,通过特征值筛选,我们分别从T1WI,T2WI,CE-T1WI 及 T1WI&T2WI(T1&T2),T1WI&T2WI&CE-T1WI(T1&T2&CE-T1)中特取出 5、7、5、13、15个特征值。T1&T2和T1&T2&CE-T1图像提取的特征值的相关系数,见图2。其中预测效能较高的序列组合为T1WI&T2WI,训练集的AUC值0.80,95%置信区间(95% CI)为0.74~0.85,特异性0.67,敏感性0.72;验证集的AUC值0.70,95% CI为0.55~0.84,特异性0.65,敏感性0.70(图3)。同时,基于T1&T2&CE-T1序列组合的预测模型产生了几乎相同的预测结果,训练集的AUC值0.80,95% CI为0.74~0.85,特异性0.67,敏感性0.72。验证集的AUC值0.70,95% CI为0.55~0.84,特异性为0.64,敏感性为0.70。
表1 垂体腺瘤病人的临床基本资料(n=182)
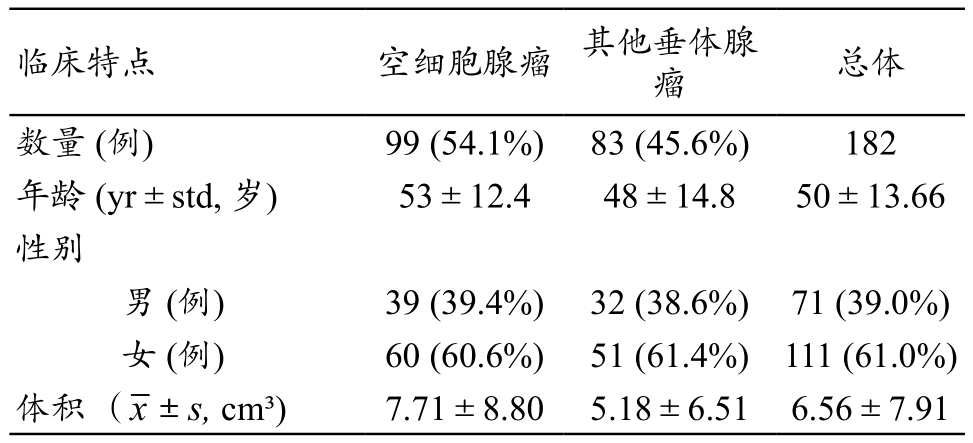
注:yr:年;std:标准偏差。
总体数量 (例) 99 (54.1%) 83 (45.6%) 182年龄 (yr±std, 岁) 53±12.4 48±14.8 50±13.66性别男 (例) 39 (39.4%) 32 (38.6%) 71 (39.0%)女 (例) 60 (60.6%) 51 (61.4%)111 (61.0%)体积 ( ±s, cm³) 7.71±8.80 5.18±6.51 6.56±7.91临床特点 空细胞腺瘤 其他垂体腺瘤
±s, cm³) 7.71±8.80 5.18±6.51 6.56±7.91临床特点 空细胞腺瘤 其他垂体腺瘤
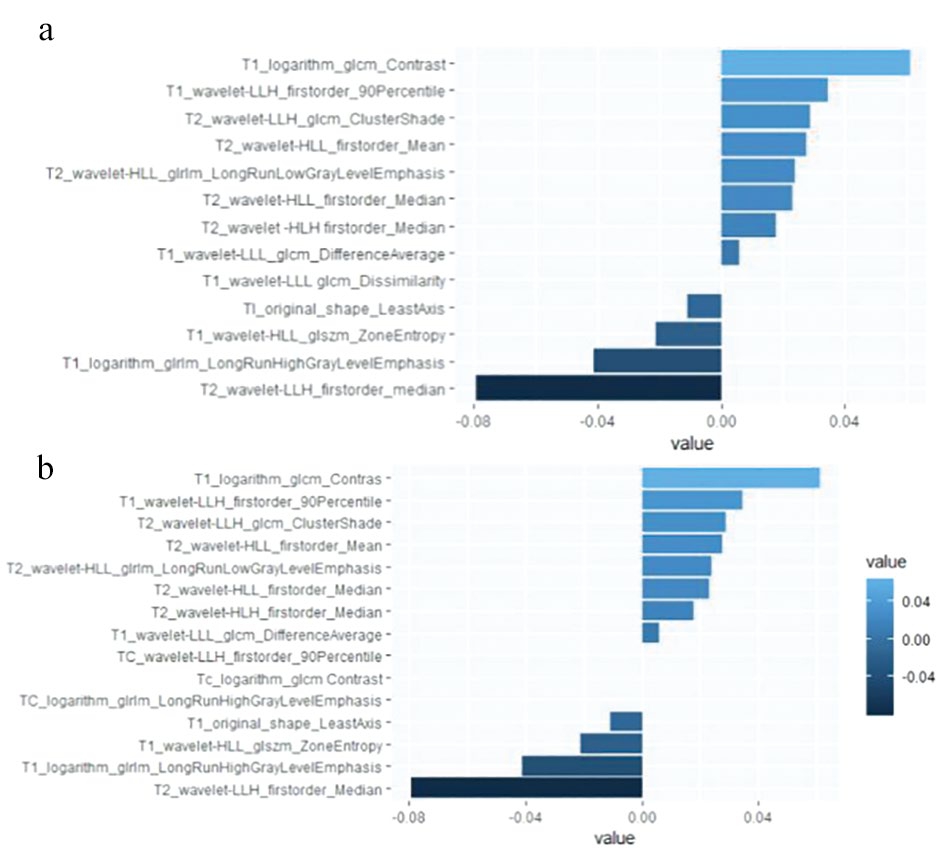
图2 T1&T2(a)以及T1&T2&CE-T1(b)图像通过Lasso算法筛选的特征值的相关系数
其他模型预测结果如下:基于T1W、T2WI及CET1WI的模型训练集的结果分别为:AUC值0.74,95% CI为0.67~0.81,特异性为0.67,敏感性为0.71;AUC值为0.76,95% CI为0.69~0.82,特异性为0.67,敏感性为0.71;AUC值0.74,95% CI为0.60~0.81,特异性0.67,敏感性0.71。基于T1W、T2WI及CE-T1WI的模型验证集的结果分别为:AUC值0.68,95% CI为0.53~0.83,特异性为0.47,敏感性为0.85;AUC 值为0.69,95% CI为0.52~0.85,特异性0.70,敏感性为0.80;AUC值为0.68,95% CI为0.53~0.83,特异性为0.47,敏感性为0.85(表2)。基于T1&T2构建的模型训练集与验证集ROC曲线,见图3。
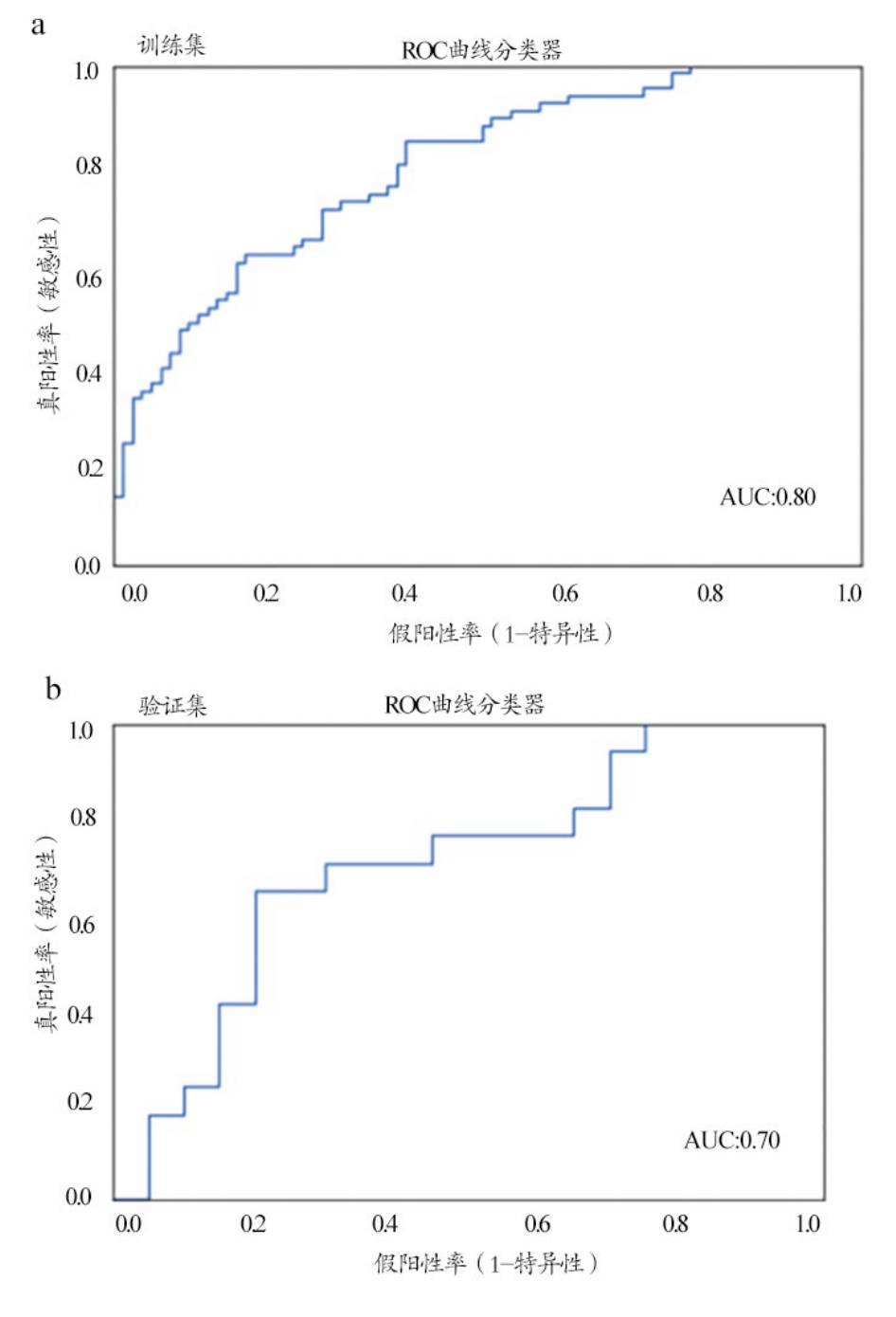
图3 基于T1&T2构建的影像组学模型的ROC曲线图(a)训练集(b)验证集
3 讨论
我们提出了运用影像组学,建立一种无创性鉴别空细胞腺瘤与其他类型垂体腺瘤的方式。通过比较T1WI,T2WI,CE-T1WI序列及其序列组合的逻辑回归模型预测结果。初步结果表明,基于T1&T2及T1&T2&CE-T1序列组合建立的模型预测效能要高于单一序列组合。而且根据T1&T2及T1&T2&CE-T1序列组合构建的模型结果比较,两者之间并无明显差异。
垂体免疫组化的结果是鉴别垂体空细胞腺瘤的重要指标,但该结果仅能在术后获得。虽然手术仍是现在空细胞腺瘤首选的治疗方式,但已有研究指出[13],放疗对于治疗空细胞腺瘤有效。绝大多数空细胞腺瘤和其他免疫组化阳性的无功能腺瘤在临床上均表现为无功能,而血清学又会受到肾上腺病变、紧张心理、垂体柄效应[14]等因素的影响,导致血清学激素与免疫组化结果一致性较差,从而增加了空细胞腺瘤与其他类型垂体腺瘤的鉴别难度。影像组学为垂体腺瘤免疫组化结果的无创性术前预测提供了一种可行性的鉴别手段。
表2 不同序列及序列组合构建模型的预测结果

变量&模型训练集验证集T1WI T2WI CE-T1WIT1&T2 T1&T2&CE-T1 T1WI T2WI CE-T1WIT1&T2 T1&T2&CE-T1 AUC 0.74 0.76 0.74 0.8 0.8 0.68 0.69 0.68 0.7 0.7 95% CI 0.67~0.81 0.69~0.82 0.67~0.81 0.74~0.85 0.74~0.85 0.53~0.83 0.52~0.85 0.53~0.83 0.55~0.84 0.55~0.84敏感性 0.71 0.71 0.71 0.72 0.72 0.85 0.8 0.85 0.7 0.7特异性 0.67 0.67 0.67 0.67 0.67 0.47 0.7 0.47 0.65 0.64
根据Roelfsema等[5]的统计研究,近30年来,垂体腺瘤治疗的成功率并未得到明显改善,仅仅在复发率方面有轻度下降。这可能与没有较为可靠的评价手段有关,对于垂体腺瘤的诊断及治疗多是根据专家意见及一部分单中心研究[15-16]。无功能垂体腺瘤包含几乎全部的空细胞腺瘤和大多数促性腺激素腺瘤,其中免疫组化阳性的无功能腺瘤很大部分为促性腺激素腺瘤[3, 17-18]。Diri等[4]也指出,无功能腺瘤LH免疫组化阳性的复发率高于LH阴性,空细胞腺瘤是复发率最低的病理亚型。上述结果表明垂体腺瘤免疫组化的结果是其预后评估的一项重要参考,影像组学通过术前无创性评估垂体免疫组化结果,为垂体腺瘤的预后评估提供了更多的参考。
迄今为止,除了Zhang等[19]跟Galm等[20]的研究之外,我们尚未发现其他关于垂体腺瘤相关的影像组学文献。Zhang等[19]的研究基于矢状位T1WI,CE-T1WI序列图像,运用支持向量机(SVM)构建机器学习模型,完成对空细胞腺瘤与其他无功能腺瘤的鉴别。我们通过扩大样本量和增加图像序列,运用逻辑回归模型实现对空细胞腺瘤与其他类型垂体腺瘤的鉴别。实验结果表明两个预测效能最高的模型从T1WI与CE-T1WI提取的特征值是相同的,而且基于T1WI&T2WI与T1WI&T2WI&CE-T1WI序列组合构建的模型预测结果几乎相同,而由图2可以看出,CET1WI提取的特征值的相关系数明显低于其他序列提取的特征值的相关系数,并在预测结果中得到了验证。我们的实验结果表明,增强序列对于鉴别空细胞腺瘤与其他类型腺瘤的预测作用不大。在Zhang等[19]的研究中,T1WI图像构建的模型要优于T1WI&CE-T1WI序列组合构建的模型,与我们的实验结果略有差别,但均提示CE-T1WI对于鉴别空细胞腺瘤与其他类型垂体腺瘤的作用较小。Galm等[20]的研究表明垂体腺瘤的纹理特征与无功能腺瘤预后复发具有相关性。
本研究仍存在一定的局限性。首先,本研究所纳病例局限于单一中心,多中心研究有助于提高模型的兼容性及准确性;其次,部分垂体腺瘤边缘模糊(尤其当侵及海绵窦时),肿瘤分割时容易导致边界遗漏问题[21],但边界遗漏目前无法避免,只能尽可能减少;另外,本模型中预测性能尚有提升空间,相信通过算法的优化可以够进一步提高模型的预测效能。
综上所述,本研究利用垂体腺瘤的MR平扫及增强图像,为术前无创性预测垂体腺瘤的免疫学状态提供了一个新的方法。通过影像组学方法鉴别空细胞腺瘤与其他类型垂体腺瘤,为垂体腺瘤的术前诊断及评估提供更多的信息,更好地实现个性化的治疗,以求达到精准医疗的目的。
[1] Theodros D,Patel M,Ruzevick J,et al. Pituitary adenomas:historical perspective, surgical management and future directions[J].Cns Oncol,2015,4(6):411-429.
[2] Tjornstrand A,Gunnarsson K,Evert M,et al.The incidence rate of pituitary adenomas in western Sweden for the period 2001-2011[J].Eur J Endocrinol,2014,171(4):519-526.
[3] Lopes MBS.The 2017 World Health Organization classification of tumors of the pituitary gland: a summary[J].Acta Neuropathol,2017,134(4):521-535.
[4] Diri H,Ozaslan E,Kurtsoy A,et al.Is positive staining of non-functioning pituitary adenomas for luteinizing hormone associated with a poor prognosis?[J].Turk Neurosurg,2017,27(1):8-13.
[5] Roelfsema F,Biermasz NR,Pereira AM.Clinical factors involved in the recurrence of pituitary adenomas after surgical remission: a structured review and meta-analysis[J].Pituitary,2012,15(1):71-83.
[6] Neggers SJ,Aj VDL.Medical approach to pituitary tumors[J].Handb Clin Neurol,2014,124(124C):303.
[7] Molitch ME.Diagnosis and treatment of pituitary adenomas: A review[J].Jama,2017,317(5):516-524.
[8] Tjornstrand A,Gunnarsson K,Evert M,et al.The incidence rate of pituitary adenomas in western Sweden for the period 2001-2011[J].Eur J Endocrinol,2014,171(4):519-526.
[9] Gillies RJ,Kinahan PE,Hricak H.Radiomics: Images are more than pictures, they are data[J].Radiology,2015,278(2):151169.
[10] Wu J,Aguilera T,Shultz D,et al.Early-stage non-small cell lung cancer: quantitative imaging characteristics of (18)F fluorodeoxyglucose PET/CT allow prediction of distant metastasis[J].Radiology,2016,281(1):151829.
[11] Li H,Zhu Y,Burnside ES,et al.MR imaging radiomics signatures for predicting the risk of breast cancer recurrence as given by research versions of mammaprint, oncotype DX, and PAM50 gene assays[J].Radiology,2017,281(2):152110.
[12] Huang YQ,Liang CH,He L,et al.Development and validation of a radiomics nomogram for preoperative prediction of lymph node metastasis in colorectal cancer[J].J Clin Oncol,2016,34(4):2157-2164.
[13] Oruçkaptan HH,Senmevsim Ö,Özcan OE,et al.Pituitary adenomas: results of 684 surgically treated patients and review of the literature[J].J Clin Oncol,2000,53(3):211-219.
[14] Molitch ME.Nonfunctioning pituitary tumors and pituitary incidentalomas[J].Endocrinol Metab Clin North Am,2008,37(1):151-171.
[15] Vilar L,Freitas MC,Naves LA,et al.Diagnosis and management of hyperprolactinemia: results of a Brazilian multicenter study with 1234 patients[J].J Endocrinol Invest,2008,31(5):436-444.
[16] Lake MG,Krook LS,Cruz SV.Pituitary adenomas: an overview[J].Am Fam Phys,2013,88(5):319-27.
[17] Mayson SE,Snyder PJ.Silent (clinically nonfunctioning)pituitary adenomas[J].J Neurooncol,2014,117(3):429-436
[18] Mayson SE,Snyder PJ.Silent pituitary adenomas[J].Endocrin Metab Clin,2015,44(1):79-87.
[19] Zhang S,Song G,Zang Y,et al.Non-invasive radiomics approach potentially predicts non-functioning pituitary adenomas subtypes before surgery[J].Eur Radiol,2018:1-10.
[20] Galm BP,Martinez-Salazar EL,Swearingen B,et al.MRI texture analysis as a predictor of tumor recurrence or progression in patients with clinically non-functioning pituitary adenomas[J].Eur J Endocrinol,2018,179(3):191-198.
[21] Hossain MM,AlMuhanna K,Zhao L,et al.Semiautomatic segmentation of atherosclerotic carotid artery wall volume using 3D ultrasound imaging[J].Med Phys,2015,42(4):2029-2043.
MR-Based Radiomics Study in the Discrimination of Null Cell Adenoma From Other Pituitary Adenomas