广西医疗器械审评改革的现状分析与思考
引言
医疗器械产品质量关乎民生和公共安全问题。近年来,医疗器械产业发展迅猛[1],年均增长率保持在两位数,迎来了发展的黄金时代。2014年,国务院发布修订后的《医疗器械监督管理条例》[2](国务院令第650号)以来,国家总局启动了与之配套规章、规范性文件的修订工作,先后发布了9部配套规章、40余项规范性文件和200余项指导原则,医疗器械监管法规体系已经日趋完备。特别是2015年8月国务院《关于改革药品医疗器械审评审批制度的意见》[3]和2017年10月中办国办《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》[4]的发布,集中体现了党中央国务院医疗器械监管战略决策部署。但是改革越深入,遇到的深层次的矛盾越多,医疗器械审评制度不完善、不适应等问题就越突出。本文针对广西医疗器械审评审批的现状,分析存在的问题,提出对策措施。
1 广西医疗器械审评查验现状
1.1 技术审评部门
广西壮族自治区食品药品审评查验中心自2007年11月开始承接医疗器械审评查验工作,2016年12月增挂广西医疗器械技术审评中心牌子,主要职责为:第二类医疗器械产品注册的技术审评和现场检查;第三类医疗器械产品注册的现场检查;医疗器械生产企业生产许可的现场检查;医疗器械分类界定的初审;创新医疗器械的初审;医疗器械审评专家、规范检查员、体系考核员的使用和日常管理工作。中心现有医疗器械技术审查人员8人,均为本科以上学历,其中研究生4人,具有中高级以上技术职称4人。机构负责人1人,分管领导1人,均为药学专业;医疗器械审评查验科6人,其中医疗器械专业2人,药学、卫生毒理、化工等相关专业4人。
1.2 近三年注册申请情况
1.2.1 2015年至2017年产品申报总量
2015年至2017年申报品种数,见表1。随着监管工作的需要,自2016年起,中心先后承接了省局委托的创新医疗器械特别审批初审工作职责,医疗器械生产许可和分类界定工作职责,医疗器械临床试验核查工作职责。2017年中心医疗器械工作量较2016年增长率达48%。
表1 2015年至2017年申报品种数(件)
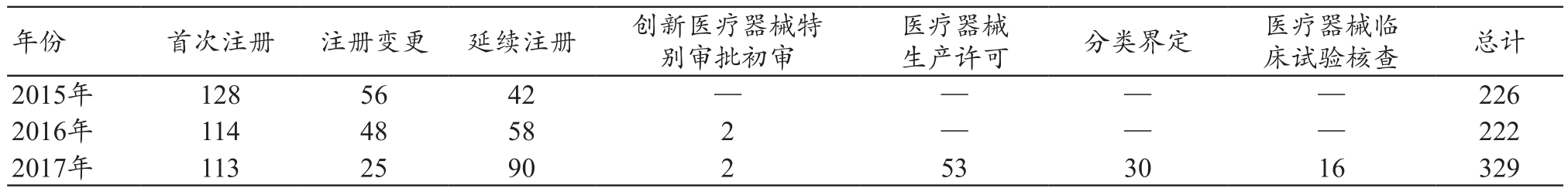
年份 首次注册 注册变更 延续注册 创新医疗器械特别审批初审生产许可分类界定医疗器械临床试验核查总计2015年1285642 — — — — 226 2016年 114 48 58 2 — — — 222 2017年 113 25 90 2 53 30 16 329医疗器械
据统计,2015年至2017年首次注册、注册变更、延续注册申报件数总量变化不大,年均225件。其中,首次注册件数趋于平缓,年均118件。注册变更申报总量有所下降,主要是占比较大的体外诊断试剂注册变更数量下降。2015年体外诊断试剂注册变更32件,占总量57%;2016年体外诊断试剂注册变更29件,占总量60%;2017年体外诊断试剂注册变更6件,占总量24%。延续注册数量增长率较大,2017年延续注册件数较2016年增长55%。
目前,广西医疗器械大多数企业生产的产品都集中在中、低端领域[5],主要是因为广西具有较低生产成本,享受注册收费政策的相对倾斜,对本地销售渠道掌握的优势等。广西生产企业主要集中在低技术、低附加值的Ⅱ类生产企业中,义齿生产企业占比达44%。广西较大型的企业主要集中于生产一些耗材产品,如常见的体外诊断试剂、医用检查手套、一次性输液器等,注册申报量比较大的占比是体外诊断试剂。而其他医疗器械企业,主打产品基本在十个以内,品种分类比较散,科技含量不高,产品区分度低,可复制度很高,注册申报量占比较小。2017年12月,广西区财政厅、物价局核定医疗器械产品注册收费标准,实行减免优惠政策,对符合工信部作出的《中小企业划型标准规定》条件的小微企业免收首次注册费、对创新医疗器械产品免收首次注册费等。由此看来,未来几年产品首次注册申报量将继续趋于平缓,变更注册申报量会有所下降,延续注册受注册证书到期续证影响,会在申报总量中占比上升。1.2.2 2015年至2017年审评工作完成总量
据统计(图1),2015年至2017年,现场核查和技术审评完成工作数量呈逐年递增趋势,2017年现场考核较2016年增长30%,2016年较2015年增长60%。2017年完成技术审评件数较2016年增长34%,2016年较2015年增长20%。
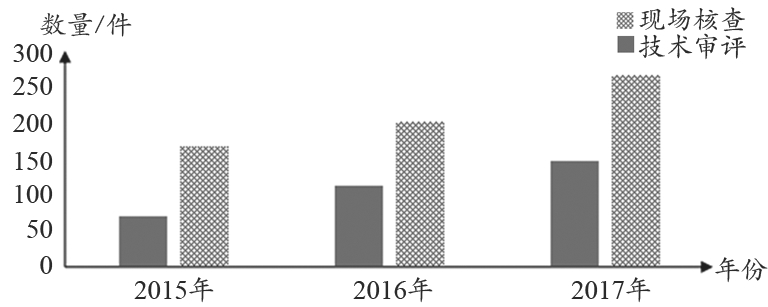
图1 2015年至2017年现场核查和技术审评完成工作数量
2 常见的问题统计及原因分析
2.1 审评中常见的问题统计及原因分析
随着2014年《医疗器械注册管理办法》等一系列新法规的陆续颁布实施,产品注册技术指导原则不断完善,但大部分企业注册申报观念还未完全转变,存在基础性问题比较多。其中,首次注册申报材料中有源、无源医疗器械存在较多问题的是医疗器械安全有效基本要求清单,占比16%;其次是临床评价资料,占比15%(图2)。体外诊断试剂首次注册申报资料中,如注册申请表,主要是产品的预期用途、主要组成成分等内容存在问题,占比18%;说明书部分主要存在列举内容不全,或与申报材料前后不一致等问题,占比14%(图3)。由于大部分申报企业的注册申报员缺少相应的培训,对注册的有关法规解读不足,导致多数申报资料撰写不规范,申报资料的内容未根据产品的特性阐述其理由。

图2 有源、无源医疗器械类产品首次注册申报资料存在问题频次
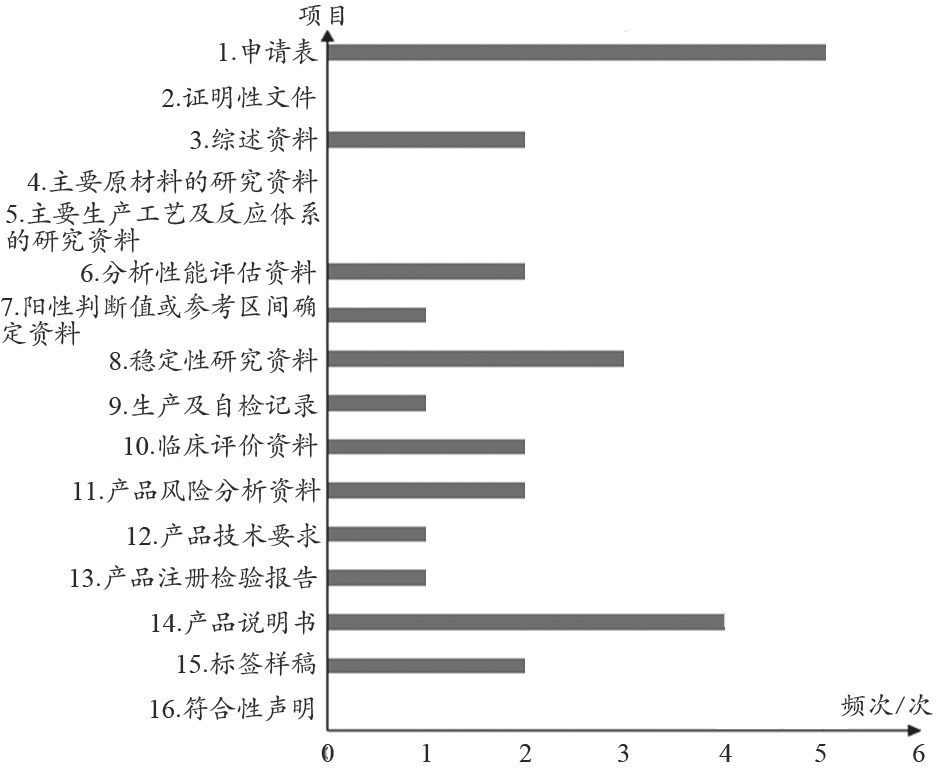
图3 体外诊断试剂类产品首次注册申报资料存在问题频次
2.2 现场核查中常见的问题统计及原因分析
2015年医疗器械生产质量管理规范、附录、现场检查指导原则陆续颁布实施,医疗器械生产质量管理要求更严更规范。从注册质量管理体系核查、许可现场检查情况来看,企业体系管理上存在较多问题(图4),其中出现频次较高的为文件管理部分,占比17%;其次为机构和人员部分、厂房和设计部分,占比约15%。主要是企业对医疗器械生产质量管理规范及指导原则的理解和认识不足,对检查不够重视[6],未按相关要求仔细自查;企业负责人、重要岗位人员对法律法规认识不够;员工培训不到位,对相应岗位操作规程不熟悉,人员整体素质有待提高;对验证工作重视程度不够等。显然,医疗器械生产企业的质量意识和规范意识有待提升,仍需努力改进。
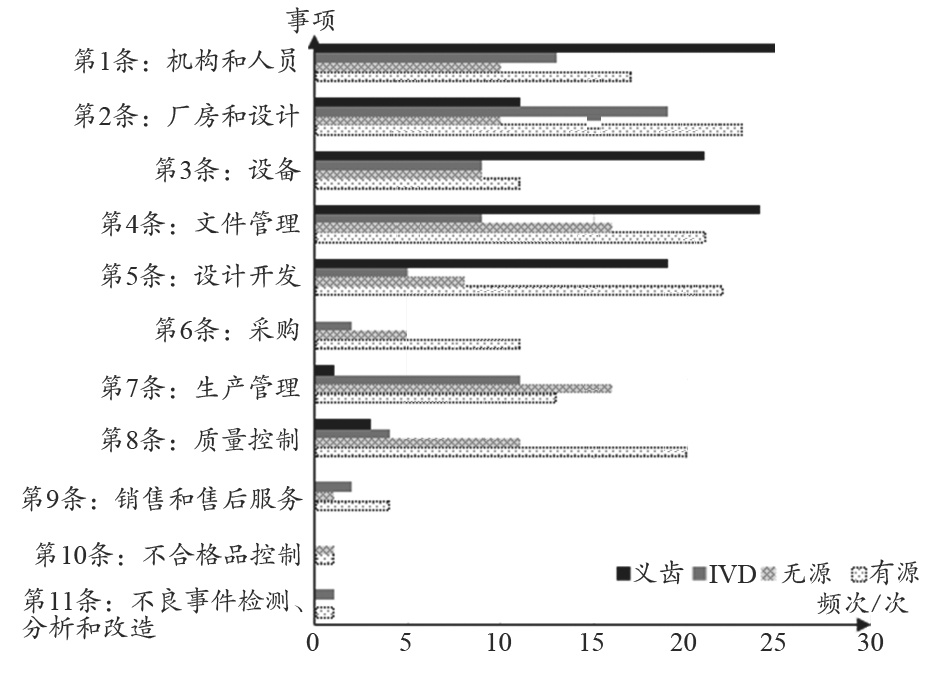
图4 医疗器械生产质量管理规范检查缺陷条款频次
目前广西生产企业200余家,主要为中小型企业,总体来说,专职从事高新技术研制、设计开发、注册人数偏少,产品创新能力不足,注册工作开展颇为吃力。
2.3 审评查验能力中存在的主要问题
技术审评力量的结构与能力急需优化增强。审评团队的技术力量不足,当前审评员数量偏少,到岗时间短,专业集中在药学、医疗器械、生物医学方面。审评专家库大部分存在临床机构专家数量过多,科研、检测机构等单位专家数量不足,专业领域和学科数量偏少的状况。医疗器械行业是一个多学科交叉、知识与资金密集的高技术产业[7],涉及医药、机械、电子、生物、材料等多个领域。高学历人才、对口专业型人才偏少[8]。高层次人才缺乏,收入待遇较低等[9],同时现有人员的培训力度、培训方式有待加强[10]。
查验工作中存在检查员抽调困难,检查企业次数趋于频繁的现象。检查员队伍的在库人员多为区级、市县级监管部门和检测机构、审评机构人员。检查员专业领域范围不广,参加检查、培训次数过少。目前,查验工作量一年大约150个品种需要开展检查,包括注册品种开展质量管理体系核查和生产许可核查,有可能会存在一个月内因为不同的申请事项,对同一企业进行多次检查的现象。
3 审评改革的策略探讨
3.1 不断完善审评制度,规范审评管理工作
优化程序,确保工作优质高效。不断完善工作流程,缩短审批时限,化繁为简[11],尽可能将可以避免重复的检查合并,节约行政资源及企业的成本和时间;建立由医疗器械、卫生毒理、化工等专业人员组成的审评队伍,负责创新医疗器械审评,提高审评审批效率[12],缩减注册审批时间,特别是高端医疗器械的注册审批;建立健全审评审批制度体系,细化制度文件,加强对审评审批工作和人员的刚性约束;一是按工作事项制定工作规程,就首次注册、延续注册、注册变更、创新医疗器械特别审批初审、医疗器械分类界定制定相应的技术审评组织与实施工作程序,注册质量管理体系核查、医疗器械生产许可等查验工作制定相应的控制程序;二是责任约束方面,通过建立《保密制度》《工作人员廉政守则》《党风廉政建设工作制度》《责任追究制度》《质量管理体系监督检查工作程序》,严格个体责任化、强化监督的作用;三是专家管理和咨询方面,建立起《医疗器械审评专家管理制度》《医疗器械审评查验咨询管理制度》《与申请人业务沟通交流制度》,进一步规范咨询服务方面的工作,从而提升审评质量。
3.2 多渠道充实和提升技术审评力量
医疗器械审评工作是监管的重要技术支撑,加强审评员队伍建设和借助专家力量在医疗器械产品注册审评中的作用越来越重要。
一是充实审评员队伍,在科学合理使用事业编制的同时,面向社会招聘技术审评专业人才,实行合同管理,通过市场手段扩大审评员队伍;二是加强实践,不断提高审评员的业务能力,通过开展业务培训、驻厂实习、邀请专家进行专题讲座等途径,帮助新进人员尽快提高审评能力;三是构建好医疗器械审评专家库,扩大审评专家的专业范围,补充临床以外的专家,从而能够在审评审批环节对医疗器械质量进行把关;四是完善专家管理制度,借脑引智,借力发展,提升技术审评质量,确保审评员数量、审评专家业务素质与履行审评工作职责、提高审评工作质量相适应。
3.3 探索建立职业化的检查员队伍
目前,我局采用向社会统一招聘的方式,分两批公开招录了12名省级食品生产企业专职检查员。
结合广西医疗器械行业现状及食品检查员试点方式,探索推行职业化检查员队伍。一是建立起统一的职业化检查员培训与考核、薪酬待遇、分级管理制度,提高检查员业务水平;二是制定职业检查员工作规范,按检查事项制定统一的检查程序,实行检查工作程序化,以指导检查员开展所有基本活动,逐步实现现场检查的一致性和规范性;三是强化检查员思想道德建设,在检查员队伍中树立优秀的职业道德行为榜样,同时加强对道德方面的考核和责任落实,通过在法律和道德等多方面的约束,建立起一支公平公正的职业化检查员队伍[4]。
通过健全完善各项管理制度和薪酬保障等措施,探索职业化检查员量化考评体系,在常态化培训的基础上,将检查员能力、履职情况等方面纳入考核当中,确保今后检查员能够引得进、留得住、用得好,以完成检查工作数量和质量为考评主要依据,实现考评制度科学合理。
3.4 加强对企业人才培养,促进产业发展
医疗器械作为技术密集型产业,产品研发、技术的创新、人才的培养对未来发展有至关重要的作用[13] 。
(1)优化企业自身人才激励机制,鼓励企业为优秀专业人才提供发挥才华的空间。创新人才激励的措施,采取多元化的方式达到成功吸引人才的目的,可以通过与高校合作、借助行业协会力量、为人才提供良好的就业环境等方式引进的高层次人才,促进人才的工作积极性和创新性。
(2)在企业人才培养上加强力度,重视人才培训工作。通过学习和努力达到理想的目标,逐步养成良好的自学习惯。不断提升员工的职业素质,企业可以对学习型人才进行适当的奖励,从企业内部挑选合适的员工参加医疗器械专业培训,加强人才的成就感,推动专业技术人员的工作积极性,保障企业健康稳定的发展和进步。
总而言之,企业应该加大研发、创新方面的投入[14],重视人才的培养和重用,鼓励注册专员多参加医疗器械法律法规方面的培训[15],只有如此,医疗器械企业才能发展壮大,医疗器械产业才能承担更大的社会责任。作为审评部门逐步完善并推行咨询管理制度等服务措施,大力支持医疗器械行业人才的培养,为广西医疗器械产业发展助力。
[1] 王雪娟,王晶.我国医疗器械产业发展现状及对策探究[J].新西部(理论版),2014,(17):59.
[2] 国家食品药品监督管理总局.医疗器械监督管条例(国务院令第650号) [Z].2014.
[3] 国务院.关于改革药品医疗器械审评审批制度的意见(国发[2015]44号)[Z].2015.
[4] 国务院办公厅.关于深化审评审批制度改革鼓励药品医疗器械创新的意见(厅字〔2017〕42号)[Z].2017.
[5] 蔡仲曦,干荣富.我国医疗器械行业之现状与发展趋势[J].中国医药工业杂志,2013,44(12):1314.
[6] 徐丛.山东省医疗器械监管现状与对策研究[D].济南:山东大学,2012.
[7] 张杰.我国医疗器械现状分析及对策研究[J].经济师,2016,(6):56.
[8] 何韦静.我国医疗器械注册监管现状及审评体系建设研究[D].成都:成都中医药大学,2015.
[9] 高军,许方霄.我国药械审评效率全球最高审评人员专业功底亟待提高——全国政协委员、国家食药监管总局副局长焦红谈药械审评审批[J].首都食品与医药,2016,23(7):8。
[10] 曹芹,吴锐.四川省医疗器械监管现状分析[J].中国医疗器械信息,2017,23(8):112.
[11] 王兰明.关于改革和完善中国医疗器械注册管理制度的探讨[J].中国医疗器械杂志,2012,(6):426.
[12] 马艳红.创新致远 砥砺前行——医疗器械审评审批制度改革取得阶段性成效[J].中国食品药品监管,2017,(7):17.
[13] 褚淑贞,王恩楠,都兰娜.我国医疗器械产业发展现状、问题及对策[J].中国医药工业杂志,2017,48(6):930.
[14] 林立明.浅析我国医疗器械行业发展现状及发展趋势[J].科技创新导报,2016,13(21):107-108.
[15] 蔡伟.泰州市医疗器械安全监管的现状与对策研究[D].南京:南京理工大学,2017.
Analysis and Reflection on the Current Situation of Medical Device Evaluation Reform in Guangxi Province