SWI及1H-MRS在鉴别WHO II~IV级脑胶质瘤中的应用
引言
胶质瘤占所有原发性脑肿瘤的27.5%左右,同时占所有恶性原发脑肿瘤的80%[1]。因为磁共振增强扫描对胶质瘤分级的准确评估有一定的局限性[2],所以,本研究探讨另外两种序列扫描。
磁敏感加权成像技术(Susceptibility Weighted Imaging,SWI)是一种功能成像,可以通过显示脱氧血红蛋白,进而显示微小血管和微出血,用于评价肿瘤内血管的发生及出血情况[3]。肿瘤生长过程中伴随着血管的生长,因而理论上,SWI 对脑胶质瘤的鉴别有一定的价值。同时,也有研究表明,SWI 半定量评估肿瘤内敏感性信号(Intratumoral Susceptibility Signal,ITSS)强度对胶质瘤分级有重要的临床意义[4]。
磁 共 振 氢 质 子 波 谱(1H Magnetic Resonance Spectroscopy,1H-MRS)是一种可以反映细胞代谢的功能成像。通过量化光谱中的胆碱(Cho)、肌酸(Cr)、N-乙酰天冬氨酸(NAA)、脂质(Lip)和乳酸(Lac)等物质来反映细胞代谢物的改变[5],进而推测肿瘤的发生、发展过程。目前,1H-MRS 已经用于研究许多神经疾病的代谢变化,如脑肿瘤、癫痫、放射性损伤等[6]。
由于II、III、IV 级胶质瘤在临床表现、遗传学特征和临床管理等方面有显著差异[7],所以,针对胶质瘤各级之间的鉴别有很大的研究价值。本研究采用3.0T 磁共振扫描仪,进一步探讨SWI 及1H-MRS 两种技术对鉴别各级胶质瘤的诊断价值。
1 材料与方法
1.1 病例资料
本研究为前瞻性研究。选取2016 年4 月至2018 年3月期间到我院就诊,并经术后病理证实的脑胶质瘤患者81例。按照WHO 分级方法将上述患者分为3 组:II 级共30例,男性18 例,女性12 例,平均年龄(41.0±12.5)岁;III 级共13 例,男性6 例,女性7 例,平均年龄(43.2±12.7)岁;IV 级共38 例,男性21 例,女性17 例,平均年龄(53.5±10.9)岁。所有患者均未接受过任何放化疗,于术前完成了头颅MRI 平扫、SWI 和1H-MRS 序列扫描以及头颅MRI 增强扫描,所得图像清晰,其中运动伪影太重、波谱曲线失真的病例未纳入其中。
1.2 仪器与方法
采用GE Discovery 750W 3.0T MR 扫描仪及24 通道头颅表面线圈进行成像。扫描序列包括:① 头颅MRI平扫:轴位T1WI(TR 2087.4 ms,TE 24.0 ms),轴位T2WI(TR 5281.0 ms,TE 104.0 ms),轴位T2 FLAIR(TR 9000.0 ms,TE 95.0 ms),视野 24 cm×24 cm,层厚5.0 mm,层间距1.5 mm;② SWI 采用Ax SWAN 序列(TR 38.3 ms,TE 22.9 ms),FA 15°,视野 24 cm×21.6 cm,矩阵352×288,层厚2.0 mm,无层间距,NEX 0.69;③ 二维多体素1H-MRS检查:采用点分辨波谱(PRESS)技术(TR 1000 ms,TE 144 ms,NEX 1 次,扫描时间5′28″),选取肿瘤实质区最大层面进行定位,并涵盖肿瘤实质区、瘤周区及健侧脑组织区,定位时尽量避开了骨骼、脂肪、含气结构等,尽量避免影响结果;④ 头颅T1WI 序列的增强扫描(轴位、矢状位及冠状位)。
1.3 数据分析
将图像载入GE ADW 4.6 工作站,进行后处理重建,分别计数和测量肿瘤实质区的ITSS 评分值和1H-MRS 参数值(图1~3)。
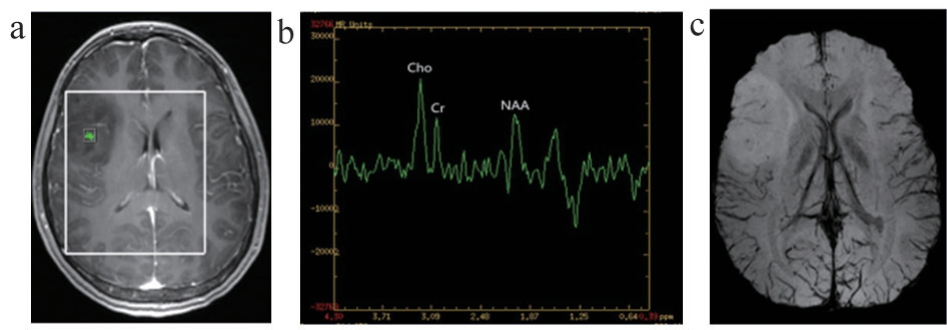
图1 WHO II级胶质瘤图像
注:女,34岁,右侧额颞叶少突胶质细胞瘤。a. 1H-MRS定位图;b. 1H-MRS肿瘤实质区相应谱线图;c. SWI肿瘤实质区的MinIP图。
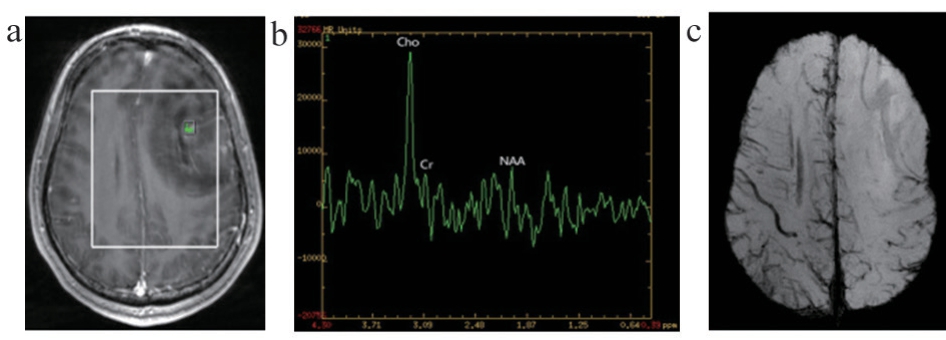
图2 WHO III级胶质瘤图像
注:男,19岁,左侧额叶间变少突胶质细胞瘤。a. 1H-MRS定位图;b. 1H-MRS肿瘤实质区相应谱线图;c. SWI肿瘤实质区的MinIP图。
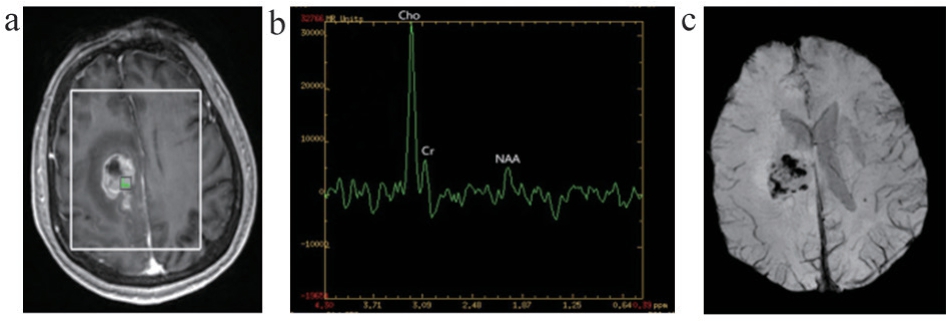
图3 WHO IV级胶质瘤图像
注:女,66岁,右侧额顶叶胶质母细胞瘤。a. 1H-MRS定位图;b. 1H-MRS肿瘤实质区相应谱线图;c. SWI肿瘤实质区的MinIP图。
通过后处理,获得SWI 的SWI MinIP 图和相位图。在SWI MinIP 图上对肿瘤内可见的低信号线性或点状的易感性病灶进行计数评分。ITSS 评分的程度分为以下几个等级[4]:0 分为没有ITSS;1 分为1~5 个点状或细线性ITSS;2 分为6~10 个点状或细线性的ITSS;3 分为11 个或更多的点状或细线性的ITSS。由于钙化在校正的相位图上表现为高信号,而微血管和微出血表现为低信号,故可以利用校正的相位图剔除钙化。
经过后处理,获得1H-MRS 代谢物与解剖图的叠加图、代谢物比率图和分布图。在定位图上,于肿瘤最大层面,选取实性部分和健侧脑组织区分别放置1~3 个感兴趣区(Region of Interest,ROI)进行测量,ROI 的大小约为56 mm2。记录病灶区的Cho、Cr、NAA、Cho/Cr、Cho/NAA 以及NAA/Cr 值,并分别计算其与健侧脑组织区代谢物的比值(相对参考值),即r Cho、r Cr、r NAA、r Cho/Cr、r Cho/NAA以及r NAA/Cr;每组数据取平均值以减少误差。
为进一步减少误差,所有数据均由三位医师重复测量取平均值得出。
1.4 统计学分析
应用SPSS 24.0 统计软件包进行分析,ITSS 采用非参数 Mann-Whitney U 检验,对1H-MRS 参数值采用单因素方差ANOVA 分析进行组间比较,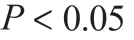 表示差异有统计学意义。利用受试者工作特性(Receiver Operator Characteristic,ROC)曲线评估两种技术对胶质瘤分级的诊断效能。
表示差异有统计学意义。利用受试者工作特性(Receiver Operator Characteristic,ROC)曲线评估两种技术对胶质瘤分级的诊断效能。
2 结果
经过统计学分析,1H-MRS 各参数的统计分析均值及P值,见表1。ITSS 值在不同级别胶质瘤中的分布情况,见表2。利用ROC 曲线分析SWI 及1H-MRS,得到曲线下面积(AUC),根据Youden 指数最大,确定敏感性和特异性(表3 和图4)。
表1 1H-MRS各参数值统计结果表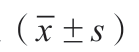
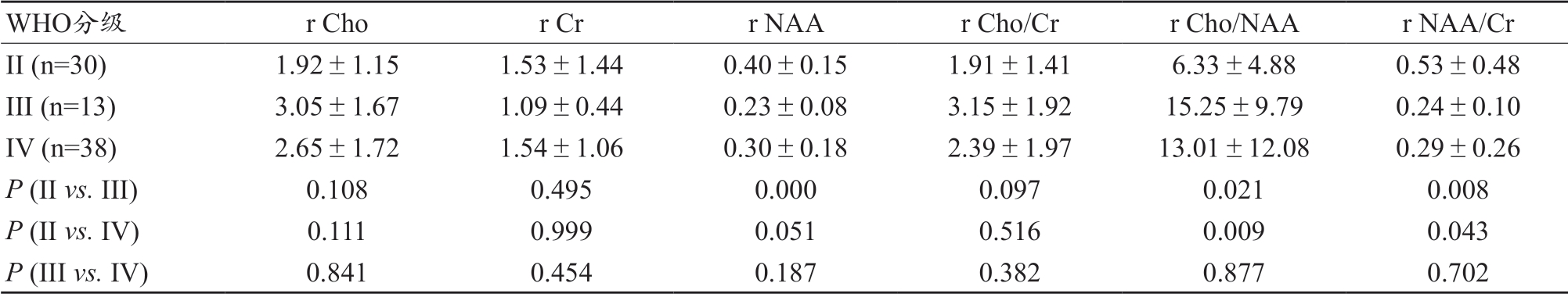
WHO分级 r Cho r Cr r NAA r Cho/Cr r Cho/NAA r NAA/Cr II (n=30) 1.92±1.15 1.53±1.44 0.40±0.15 1.91±1.41 6.33±4.88 0.53±0.48 III (n=13) 3.05±1.67 1.09±0.44 0.23±0.08 3.15±1.92 15.25±9.79 0.24±0.10 IV (n=38) 2.65±1.72 1.54±1.06 0.30±0.18 2.39±1.97 13.01±12.08 0.29±0.26 P (II vs. III) 0.108 0.495 0.000 0.097 0.021 0.008 P (II vs. IV) 0.111 0.999 0.051 0.516 0.009 0.043 P (III vs. IV) 0.841 0.454 0.187 0.382 0.877 0.702
表2 胶质瘤的ITSS值分布表(例)

WHO分级 ITSS 0 ITSS 1 ITSS 2 ITSS 3 II (n=30) 11 17 2 0 III (n=13) 1 4 1 7 IV (n=38) 0 1 0 37
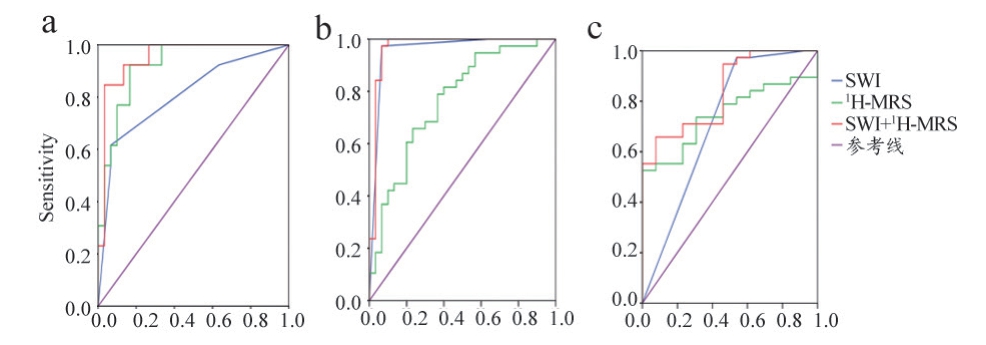
图4 ROC曲线
注:a. 鉴别II级与III级;b. 鉴别II级与IV级;c. 鉴别III级与IV级。
3 讨论
SWI 采用高分辨率、三维完全流动补偿的梯度回波序列进行扫描,经过后处理将幅值图和相位图融合,形成图像对比[8]。脱氧血红蛋白及出血的代谢产物由于快速自旋回波失相位,导致信号缺失,在SWI 图像上表现为显著的低信号[9]。
1H-MRS 作为诊断胶质瘤的补充工具[10],可以反映不同级别胶质瘤中代谢物的改变。其中胆碱(Cho)是反映细胞膜的标记,肌酸(Cr)是能量代谢的标志物,N-乙酰天冬氨酸(NAA)是神经元状态和完整性的标记。通过反映胶质细胞的神经元功能障碍、神经元丢失和反应性神经胶质增生[11],进而推测肿瘤的病理类型。
本研究数据显示:ITSS 值在区分II 级与III 级、II 级与IV 级以及III 级与IV 级中均有意义( ),表现为级别越高,ITSS 评分值越高。这提示胶质瘤级别越高,瘤内新生血管越丰富、越容易出血。分析原因可能是:① 肿瘤新生血管大多是不成熟的血管,通透性比较高且缺乏淋巴管回流,导致肿瘤血管内血液黏滞度、血流阻力明显增加[12]。所以血液停留时间过长,导致脱氧血红蛋白的产生,SWI 表现为低信号;② 胶质瘤级别越高,瘤内微小血管的病变可能越显著;③ 随肿瘤级别增高,瘤血管的生长供不应求。所以,瘤细胞分泌大量的血管内皮生长因子,极大地促进内皮细胞的增殖和血管形成[13],且由于缺氧容易导致血管内脱氧血红蛋白增多及出血,所以SWI 低信号越多,形成恶性循环。
),表现为级别越高,ITSS 评分值越高。这提示胶质瘤级别越高,瘤内新生血管越丰富、越容易出血。分析原因可能是:① 肿瘤新生血管大多是不成熟的血管,通透性比较高且缺乏淋巴管回流,导致肿瘤血管内血液黏滞度、血流阻力明显增加[12]。所以血液停留时间过长,导致脱氧血红蛋白的产生,SWI 表现为低信号;② 胶质瘤级别越高,瘤内微小血管的病变可能越显著;③ 随肿瘤级别增高,瘤血管的生长供不应求。所以,瘤细胞分泌大量的血管内皮生长因子,极大地促进内皮细胞的增殖和血管形成[13],且由于缺氧容易导致血管内脱氧血红蛋白增多及出血,所以SWI 低信号越多,形成恶性循环。
1H-MRS 参数r NAA 在鉴别II 级与III 级有统计学意义( ),r Cho/NAA、r NAA/Cr 在鉴别II 级与III 级、II 级与IV 级中有统计学意义(
),r Cho/NAA、r NAA/Cr 在鉴别II 级与III 级、II 级与IV 级中有统计学意义(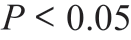 ),表现为肿瘤级别越高,NAA 含量相对越少。这与以往的研究部分类似[14-15]。NAA 含量低,表明正常神经元受侵犯,原因可能是随胶质瘤级别增高,侵袭性随之明显,肿瘤细胞侵犯正常神经元结构。有研究表明,Cr 相对恒定,且不受病理改变的影响,通常用作计算代谢物水平的内部参考[16],本研究结果Cr 变化不显著,进一步支持了这一观点。同时,本研究中r Cho值也无统计学意义,分析原因可能是,不同级别胶质瘤虽然瘤细胞增殖不同,但是总体的膜数量或面积差别不大。
),表现为肿瘤级别越高,NAA 含量相对越少。这与以往的研究部分类似[14-15]。NAA 含量低,表明正常神经元受侵犯,原因可能是随胶质瘤级别增高,侵袭性随之明显,肿瘤细胞侵犯正常神经元结构。有研究表明,Cr 相对恒定,且不受病理改变的影响,通常用作计算代谢物水平的内部参考[16],本研究结果Cr 变化不显著,进一步支持了这一观点。同时,本研究中r Cho值也无统计学意义,分析原因可能是,不同级别胶质瘤虽然瘤细胞增殖不同,但是总体的膜数量或面积差别不大。
另外,有研究显示,Cho/NAA、NAA/Cr 可用于胶质瘤分级,而Cho/Cr 无分级价值[17]。也有文献报道,高、低级别胶质瘤之间的NAA/Cho、NAA/Cr、Cho/Cr 均有统计学差异[18]。而本研究中,r Cho/Cr 在胶质瘤分级中无意义,与前者结果类似。这至少说明,Cho/Cr 相关参数在胶质瘤分级中是不稳定的。分析其原因,可能是各级胶质瘤中Cho 及Cr 变化不显著,导致Cho/Cr 相关参数相对不准确。而在肿瘤生长活跃区NAA 破坏是明显的[19],所以NAA 相关参数(包括r NAA、r Cho/NAA、r NAA/Cr)对胶质瘤的分级意义更大。通过对1H-MRS 各个参数分别进行ROC曲线分析,发现r NAA 在鉴别II 级与III 级、II 级与IV 级中的AUC 值也最大(分别为0.828 和0.697),进一步证实了这一推论。
表3 各参数的AUC值、敏感性和特异性

WHO II vs. WHO III WHO II vs. WHO IV WHO III vs. WHO IV AUC 敏感性 特异性 AUC 敏感性 特异性 AUC 敏感性 特异性SWI 0.806 0.615 0.933 0.958 0.974 0.933 0.718 0.974 0.417 1H-MRS 0.921 0.923 0.833 0.764 0.658 0.767 0.747 0.526 0.980两者联合 0.949 0.846 0.967 0.968 0.974 0.933 0.840 0.658 0.923
SWI 在鉴别II 级与IV 级中AUC 值最大(0.958),敏感性和特异性分别为97.4%、93.3%。1H-MRS 在鉴别II 级与III 级中AUC 值最大(0.921),敏感性和特异性分别为92.3%、83.3%。在鉴别III 级和IV 级的差别中,仅SWI 有统计学意义,而且两种技术的AUC、敏感性和特异性均相对比较低。分析原因可能是,III 级和IV 级同属于高级别胶质瘤,在代谢改变的情况上,二者差异不够显著。而在血管生成程度方面虽然有差异,但是敏感性和特异性不如鉴别II 级与IV 级、II 级与III 级。此外,综合两种技术获得的AUC 值,在各组中均为最大,敏感性和特异性也较高,尤其对II 级和IV 级的鉴别更为显著。
综上,1H-MRS 仅对鉴别II 级和III 级、II 级和IV 级有临床意义,SWI 对鉴别各级胶质瘤都有临床意义;并且SWI 的AUC、敏感性和特异性相对较高。联合两种技术,具有最高的敏感性和特异性,有更高的临床价值。
本研究的局限性:本研究主要探讨肿瘤实质内1H-MRS及SWI 的信息,所以并未涉及瘤周水肿区的生化信息;后续的研究将进一步对瘤周区域展开探讨。
[1] Ostrom QT,Gittleman H,Xu J,et al.CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2009-2013[J].Neuro Oncol, 2016,18(S5):v1-v75.
[2] Bund C,Heimburger C,Imperiale A,et al.FDOPA PET-CT of nonenhancing brain tumors[J].Clin Nucl Med,2017,42(4):250-257.
[3] Li X,Zhu Y,Kang H,et al.Glioma grading by microva-scular permeability parameters derived from dynamic contrast enhanced MRI and intratumoral susceptibility signal on susceptibility weighted imaging[J].Cancer Imaging, 2015,15(1):4.
[4] Park MJ,Kim HS,Jahng GH,et al.Semiquantitative assessment of intratumoral susceptibility signals using non-contrast-enhanced high-field high-resolution susceptibility-weighted imaging in patients with gliomas:comparison with MR perfusion imaging[J].AJNR Am J Neuroradiol,2009,30(7):1402-1408.
[5] Ricci PE,Pitt A,Keller PJ,et al.Effect of voxel position on single-voxel MR spectroscopy findings[J].AJNR Am J Neuroradiol,2000,21(2):367-374.
[6] Sidek S,Ramli N,Rahmat K,et al.In vivo proton magnetic resonance spectroscopy (1H-MRS) evaluation of the metabolite concentration of optic radiation in primary open angle glaucoma[J].Eur Radiol,2016,26(12):4404-4412.
[7] Wang Y,Jiang T.Understanding high grade glioma: molecular mechanism, therapy and comprehensive management[J].Cancer Lett,2013,331(2):139-146.
[8] Rauscher A,Sedlacik J,Barth M,et al.Magnetic susceptibilityweighted MR phase imaging of the human brain[J].AJNR Am J Neuroradiol,2005,26(4):736-742.
[9] Hermier M,Nighoghossian N.Contribution of susceptibilityweighted imaging to acute stroke assessment[J].Stroke,2004,35(8):1989-1994.
[10] Chen R,Cohen AL,Colman H.Targeted therapeutics in patients with high-grade gliomas: past, present, and future[J].Curr Treat Options Oncol,2016,17(8):42.
[11] Aydin H,Oktay NA,Kizilgoz V,et al.Value of proton-MR-spectroscopy in the diagnosis of temporal lobe epilepsy; correlation of metabolite alterations with electroencephalography[J].Iran J Radiol,2012,9(1):1-11.
[12] 陶伟,王一民,张羽,等.磁敏感加权成像在脑胶质瘤分级中的应用价值[J].中国医药导报,2013,10(15):134-137.
[13] Mahase S,Rattenni RN,Wesseling P,et al.Hypoxia-Mediated mechanisms associated with antiangiogenic treatment resistance in glioblastomas[J].Am J Pathol,2017,187(5):940-953.
[14] 姜亮,刘文,肖朝勇,等.探讨联合应用MRS和DWI在脑胶质瘤分级中的诊断价值[J].临床放射学杂志,2015,34(4):514-519.
[15] Oshiro S,Tsugu H,Komatsu F,et al.Quantitative assessment of gliomas by proton magnetic resonance spectroscopy[J].Anticancer Res,2007,27(6A):3757-3763.
[16] Lunsing RJ,Strating K,de Koning TJ,et al.Diagnostic value of MRS-quantified brain tissue lactate level in identifying children with mitochondrial disorders[J].Eur Radiol, 2017,27(3):976-984.
[17] Server A,Kulle B,Gadmar OB,et al.Measurements of diagnostic examination performance using quantitative apparent diffusion coefficient and proton MR spectroscopic imaging in the preoperative evaluation of tumor grade in cerebral gliomas[J].Eur J Radiol,2011,80(2):462-470.
[18] Caivano R,Lotumolo A,Rabasco P,et al.3 Tesla magnetic resonance spectroscopy: cerebral gliomas vs. metastatic brain tumors. Our experience and review of the literature[J].Int J Neurosci,2013,123(8):537-543
[19] Bieza A,Krumina G.Magnetic resonance study on fractional anisotropy and neuronal metabolite ratios in peritumoral area of cerebral gliomas[J].Medicina,2012,48(10):497-506.
Application of SWI and 1H-MRS in the Identification of WHO II to IV Gliomas