3.0T MRI与CT在评价术前新辅助放疗或同步放化疗对中晚期低位直肠癌疗效中的应用价值
引言
作为最为常见的消化道肿瘤,因生活水平不断提高以及粗纤维食物摄入减少,直肠癌的发病率在逐年递增。因直肠癌临床特征不明显,患者在就诊时往往已处于晚期[1]。近些年来,主要采用术前新辅助放疗或者同步放化疗(Neoadjuvant Chemoradiotherapy,NACRT)来降低直肠癌的复发率,有效改善患者的生活质量,但是其长期生存率和远处转移率却没有得到显著改善[2]。对于晚期直肠癌,欧美国家在多采用NACRT 术后行全直肠系膜切除术(Tatal Mesorectal Excision,TME)进行治疗。手术治疗前进行系统评估至关重要,目前多采用盆腔磁共振成像(Magnetic Resonance Imaging,MRI)来对中低位直肠癌的T 分期进行评估,文献报道称其准确率显著高于多层螺旋CT(Multisliecs Helical CT,MSCT)[3],但二者在NACRT后对直肠癌患者评估价值优劣尚未见有明确的报道。因此本研究选取中低位进展期直肠癌患者作为研究对象,然后分析对比MSCT 和MRI 在疗效评估中应用价值。
1 资料和方法
1.1 一般资料
选取2016 年2 月至2018 年2 月在广西百色市人民医院就诊的直肠癌患者作为研究对象。纳入标准:① 经病理学活检确诊为进展期直肠癌;② 所有患者均在术前接受新辅助放疗(盆腔照射,总剂量为50 Gy,分次剂量2 Gy,5周内分25 次完成)或者同步放化疗(氟尿嘧啶联合奥沙利铂方案,2~3 个周期,或卡培他滨联合奥沙利铂方案,2 个周期)。结束后行TME 手术。排除标准:伴随有严重的心肾疾病患者。共纳入符合要求的患者182 例,其中男性患者100 例,女性患者82 例,年龄在30~78 岁,平均年龄为(57.81±4.89)岁。所有患者均签署知情同意书,本研究经医院伦理委员会批准展开。按照随机数字法则分为两组,其中研究组90 例,男性患者48 例,女性患者42 例,年龄在30~78 岁,平均年龄为(57.92±4.69)岁,体重指数为(25.18±3.12)kg/m2,距齿状线距离(4.98±1.32)cm,行直肠地位前切术的患者80 例,行腹会阴联合直肠癌根治术患者10 例;对照组患者92 例,男性患者52 例,女性患者40 例,年龄在31~78 岁,平均年龄为(57.72±4.96)岁,体重指数为(25.21±3.19)kg/m2,距齿状线距离(5.02±1.34)cm,行直肠地位前切术的患者81 例,行腹会阴联合直肠癌根治术患者11 例;两组患者基本资料经统计学分析无统计学意义(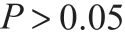 )。
)。
1.2 方法
1.2.1 研究组采用MRI检查
研究采用MagnetomVerio Time 3.0T 磁共振成像仪器(德国SIEMENS 公司)进行检查,采用高压注射器将造影剂Gd-DTPA 注入手背静脉,剂量为0.1 mmol/kg,速率2 mL/s,行T1WI 增强扫描。扫描序列:T1WI、T2WI、DWI。
1.2.2 对照组采用MSCT检查
采用GE lightspeed VCT 64 排螺旋CT 进行检测,造影器为欧乃派克(300 mgI/mL)或优维显(370 mgI/mL),肘前静脉采用高压注射器进行注射,速率:4.5 mL/s。
1.3 影像学指标
所有数据均上传到医生工作站,经后续处理阅片。由两位腹部影像学医师进行盲法阅片,结果由一名副主任医师进行复核,当意见不一致时,经讨论取得一致结果。
疗效评估:采用美国癌症研究制定的实体肿瘤评价标准(RESIST 1.1)[4],即完全缓解(CR):患者的所有病灶完全消失;部分缓解(PR):目标病灶直径总和≥30%;稳定(SD):患者的病灶无明显变化;进展(PD):目标病灶总和增大>20%。有效率=(CR+PR)/总例数×100%。
T和N分期采用国际抗癌联盟制定的TNM分期标准[5]。淋巴结转移标准:① 视野内最大强化淋巴结短径>5 mm;② 边界模糊,形态不规则;③ 强化后不均匀。
环固切缘受累(Circumferential Resection Margin,CRM)的评价标准[6]:CRM 受累:肿瘤最外缘或直肠系膜内转移淋巴结和CRM 距离≤1 mm,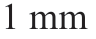 即为不受累。
即为不受累。
NACRT 前后体积改变幅度计算公式:△V(%)=(V后-V前)/V前×100%。
1.4 统计学分析
文章数据采用SPSS 16.0 分析,计量资料采用t 检验,计数采用χ2 检验,NACRT 前后T、N 分期以及CRM 受累,采用Wilcoxon’s 符号秩和检验,其与病理学参数评估采用Kappa 一致性检验,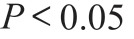 表示具有统计学意义。
表示具有统计学意义。
2 结果
2.1 两组患者NACRT后疗效对比
研究组NACRT 后CR 患者8 例,PR 患者52 例,SD患者6 例,总有效率为73.33%,对照组NACRT 后CR患者7 例,PR 患者54 例,SD 患者6 例,总有效率为72.83%,两组患者的总有效率经统计学分析无统计学意义(χ2=0.006,P=0.939)。研究组病理完全缓解患者占比为11.11%(10/90),而对照组为16.30%(15/92),经统计学分析差异无统计学意义(χ2=1.036,P=0.309)。
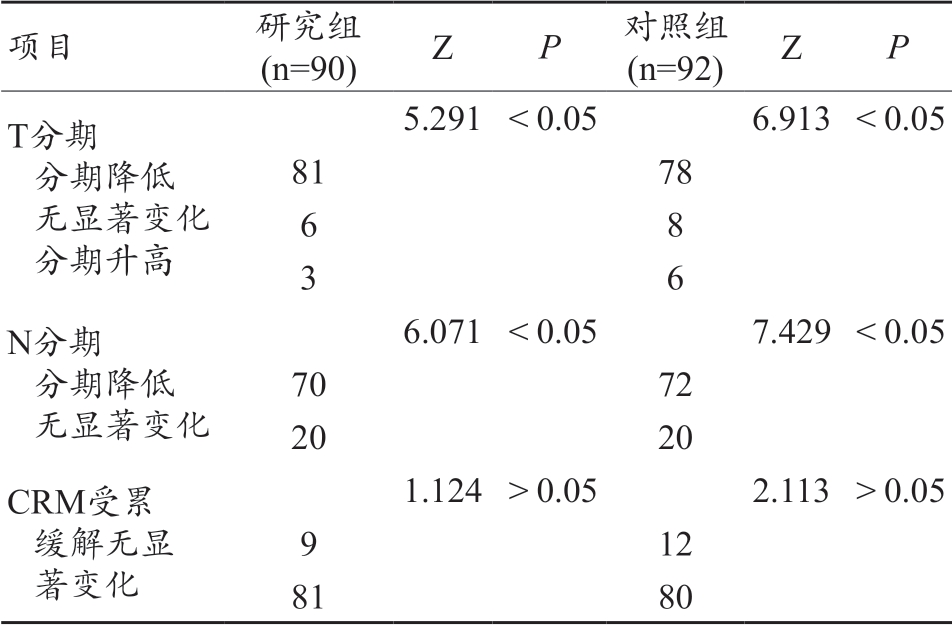
2.2 两组患者NACRT前后T、N分期以及CRM受累比较
研究组在NACRT 前后T 分期、N 分期变化差异具有 统计学 意义(Z=5.291、6.071,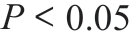 )。对 照 组 在NACRT 前后T 分期、N 分期变化差异具有统计学意义(Z=6.913、7.429,
)。对 照 组 在NACRT 前后T 分期、N 分期变化差异具有统计学意义(Z=6.913、7.429,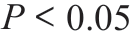 )。而两组在NACRT 前后CRM受累情况均无统计学意义(Z=1.124、2.113,
)。而两组在NACRT 前后CRM受累情况均无统计学意义(Z=1.124、2.113, ),见表1。
),见表1。
表1 两组患者NACRT前后T、N分期以及CRM受累比较(例)
项目 研究组 (n=90) Z P 对照组 (n=92) Z P T分期 分期降低 无显著变化 分期升高5.291 <0.05 6.913 <0.05 81 78 6 8 3 6 N分期 分期降低 无显著变化6.071 <0.05 7.429 <0.05 70 72 20 20 CRM受累 缓解无显 著变化1.124 >0.05 2.113 >0.05 9 12 81 80
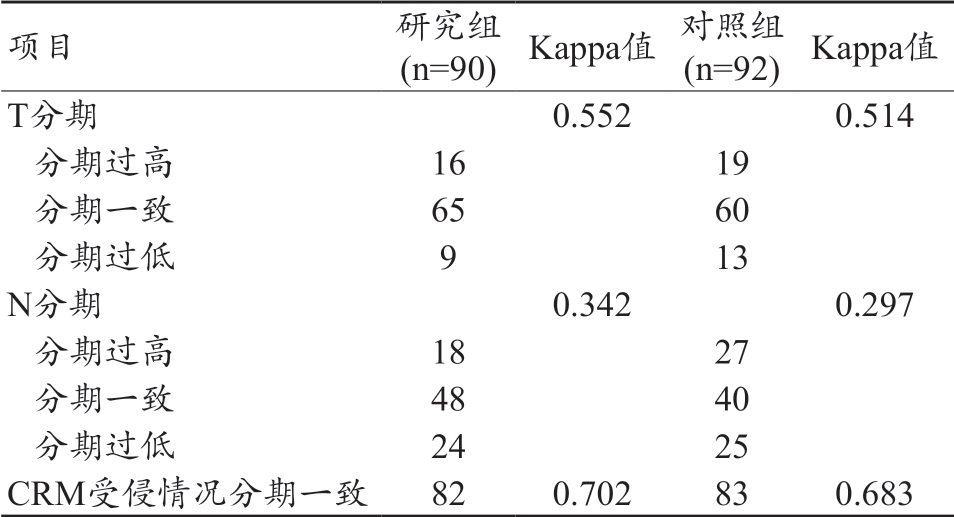
2.3 两组患者NACRT后影像学分期和病理分期比较
2.3.1 研究组NACRT后术后病理结果
研究组NACRT 后术后病理结果对照显示T 分期的一致性结果较好,Kappa=0.552,其准确率为72.22%(65/90);CRM 受累情况病理学结果之间一致性较好,Kappa=0.702,其准确率为91.11%(82/90);而N 分期的一致性较差,Kappa=0.342,其准确率为53.33%(48/90)。
2.3.2 对照组NACRT后术后病理结果
对照组NACRT 后术后病理结果对照显示T 分期的一致性结果较好,Kappa=0.514,其准确率为65.22%(60/92);CRM 受累情况病理学结果之间一致性较好,Kappa=0.683,其准确率为90.22%(83/92);而N 分期的一致性较差,Kappa=0.297,其准确率为43.48%(40/92),见表2。
表2 两组患者NACRT后影像学分期和病理分期比较(例)
项目 研究组 (n=90) Kappa值 对照组 (n=92) Kappa值T分期 0.552 0.514 分期过高 16 19 分期一致 65 60 分期过低 9 13 N分期 0.342 0.297 分期过高 18 27 分期一致 48 40 分期过低 24 25 CRM受侵情况分期一致 82 0.702 83 0.683
2.3.3 两组患者检测准确率对比
两组患者T 分期、N 分期以及CRM 受累情况的准确率比较,无统计学意义(χ2=0.009、0.000、0.043,P 均>0.05)。
3 结论
直肠癌发病率在我国恶性肿瘤中排第四,其死亡率较高,因此尽早检查及早治疗是降低其死亡率的关键[7-8]。MSCT 作为一种无创检测方法,能够清晰显示肿瘤部位、范围,对晚期直肠癌患者的分期意义重大。MRI 通过数字化模拟灰度,从而反映组织的信号强度,直肠及其膜组织能够在对比剂增强的图像上有更为清晰的界限,因此能够更为准确的的判断侵犯程度以及环周切缘是否受侵。然而因为直肠癌患者NACRT 后肿瘤会出现水肿、坏死以及纤维化,常规的影像学很难鉴别肿瘤边界,本研究通过静脉注射对比剂增强后基于RESIST 实体瘤诊断标准评估NACRT 的疗效,结果显示研究组和对照组的总有效率分别为73.33%和72.83%,组间比较无统计学意义,本研究结果和国外学者Neri 等[9]研究一致(其研究发现NACRT后瘤体缩小的有效率为75%)。在手术前,给予患者新辅助化疗后,两组患者的组织浸润程度均明显下降,文献报道[10]称在手术前对患者实施新辅助化疗,瘤体缩小效果要优于在手术后实施新辅助化疗,而本研究中两组分期降低患者的人数无统计学意义,研究组病理完全缓解患者占比为11.11%,而对照组为16.30%(15/92),经统计学分析无统计学意义,目前文献报道称MRI 病理完全缓解患者占比在9%~38%[11],可能是因为本研究纳入患者数量较少。
研究组在T、N 分期中的准确率以及一致性均高于对照组,但不显著,这可能是因为放化疗之后,患者组织出现水肿、坏死以及纤维化,MRI 和CT 均不能准确地对肿瘤进行分期。两组患者在影像学均表现过度分期,提示MSCT 和MRI 在化疗后组织坏死、纤维化组织和正常组间的鉴别效果较差[12],在T 分期上,与病理学结果对比,MSCT 和MRI一致性均较好,这可能是因为两种方法的分辨率均较高,其中研究组的一致性要高于对照组。近些年来,越来越多的学者[13-14]将MRI 应用于直肠癌中低位进展期的评价,通过功能现象、弥散加权序列以及动态增强核磁为新辅助放化疗后的再分期评价提供支持。本研究中两组没有出现明显差异,可能是纳入研究例数较少,下一步将继续扩大样本量。
近些年,越来越多的影像工作者为了提高淋巴结的阳性诊断率,开始采用淋巴结特异性造影剂,其中应用最多的是超顺磁性氧化铁(Ultrasmall Particles Of Iron Oxide,USPIO)[15-16]。文献报道称USPIO 常常用来作为鉴别良性和恶性肿瘤,称96%的良性淋巴结在T2 加权像(T2* Weighred Image,T2*WI)上表现为均匀一致或中心性低信号,而对于出现恶性淋巴结的会表现高信号和偏心性高信号[17]。因T2W1 可以区分淋巴结管和血管,对磁化系数敏感,所以目前影像工作者常常将T2W1 和T2*W1 联合起来,对直肠系膜淋巴结进行评估。目前在评估新辅助化疗后淋巴结是否侵犯方面,还未有行之有效的方法,目前多是采用多种影像学手段相结合譬如MRI、淋巴结特异性显影剂以及正电子发射计算机断层现象等,从而大大提高了淋巴结诊断的准确性[18-19]。
综上所述,本研究NACRT 可以明显减小直肠癌患者肿瘤,并且降低分期,但目前尚未发现其对CRM 受侵情况的影响。NRI 和MSCT 能够准确判断浸润程度,MRI 的Kappa 一致性略高于对照组,但差异无统计学意义。两种影像学方法均能对直肠癌治疗后的肿瘤侵犯成都进行评估,但是在评估淋巴结是否转移还需进一步深入研究。
[1] 郑树,张苏展,黄彦钦.结直肠癌研究30年回顾和现状[J].实用肿瘤杂志,2016,31(1):2-5.
[2] Sauer R,Liersch T,Merkel S,et al.Preoperative versus postoperative chemoradiotherapy for locally advanced rectal cancer: results of the German CAO/ARO/AIO-94 randomized phase III trial after a median follow-up of 11 years[J].J Clin Oncol, 2012,30(16):1926-1933.
[3] Kapiteijn E,Marijnen CA,Nagtegaal ID,et al.Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer[J].N Engl J Med,2001,345(9):638-646.
[4] 杨学宁,吴一龙.实体瘤治疗疗效评价标准—RECIST[J].循证医学,2004,4(2):85-90.
[5] 戴峥.3.0T高分辨率 MRI 直肠癌术前T分期与病理T分期对比研究[D].广州:南方医科大学,2015.
[6] Homan J,Bökkerink GM,Aarts MJ,et al.Variation in circumferential resection margin: Reporting and involvement in the South-Netherlands[J].Eur J Surg Oncol,2015,41(11):1485-1492.
[7] 尹慕军,叶颖江,姜可伟,等.腹腔镜结直肠癌手术临床疗效探讨[J].中国医药,2010,5(1):60-62.
[8] 黄冀华,梁伟成,李华江,等.腹腔镜下全直肠系膜切除术联合新辅助治疗在中低位直肠癌中的近期效果观察[J].中国医药,2015,10(1):26-30.
[9] Neri E,Guidi E,Pancrazi F,et al.MRI tumor volume reduction rate vs tumor regression grade in the pre-operative re-staging of locally advanced rectal cancer after chemo-radiotherapy[J].Eur J Radiol,2015,84(12):2438-2443.
[10] 任胜,孙振强,王海江.MRI和MSCT对进展期直肠癌新辅助疗效评估价值对比研究[J].中华肿瘤防治杂志,2017,24(5):337-340.
[11] Intven M,Monninkhof EM,Reerink O,et al.Combined T2W volumetry, DW-MRI and DCE-MRI for response assessment after neo-adjuvant chemoradiation in locally advanced rectal cancer[J].Acta Oncol,2015,54(10):1729-1736.
[12] Habr-Gama A,Sabbaga J,Gama-Rodrigues J,et al.Watch and wait approach following extended neoadjuvant chemoradiation for distal rectal cancer: are we getting closer to anal cancer management[J].Dis Colon Rectum,2013,56(10):1109-1117.
[13] Intven M,Reerink O,Philippens MEP.Diffusion-weighted MRI in locally advanced rectal cancer: pathological response prediction after neo-adjuvant radiochemotherapy[J].Strahlenther Onkol,2013,189(2): 117-122.
[14] Siegel R,DeSantis C,Jemal A.Colorectal cancer statistics, 2014[J].CA Cancer J Clin,2014,64(2):104-117.
[15] Akiyoshi T,Matsueda K,Hiratsuka M,et al.Indications for lateral pelvic lymph node dissection based on magnetic resonance imaging before and after preoperative chemoradiotherapy in patients with advanced low-rectal cancer[J].Ann Surg Oncol,2015,22(3):614-620.
[16] Uenosono Y,Arigami T,Kozono T,et al.Clinical significance of circulating tumor cells in peripheral blood from patients with gastric cancer[J].Cancer,2013,119(22):3984-3991.
[17] Mertens ME,Frese J,Boeluekbas DA,et al.FMN-coated fluorescent USPIO for cell labeling and non-invasive MR imaging in tissue engineering[J].Theranostics,2014,4(10):1002.
[18] 张燕,张国丽,贾慧,等.18F-FDGPET/CT对结直肠癌术后复发转移监测的价值[J].中华肿瘤防治杂志,2016,23(3):181-185.
[19] Gérard JP,Chamorey E,Gourgou-Bourgade S,et al.Clinical complete response (cCR) after neoadjuvant chemoradiotherapy and conservative treatment in rectal cancer. Findings from the ACCORD 12/PRODIGE 2 randomized trial[J].Radiother Oncol, 2015,115(2):246-252.
Application Value of 3.0T MRI and CT in Evaluating the Efficacy of Middle and Late Stage Low Rectal Cancer After Neoadjuvant Chemoradiotherapy