两台迈瑞BS380生化分析仪性能评价结果的比较分析
徐含青1,刘跃平1,2,府伟灵1,黄君富1,魏昆1,杨翔1,黄庆1
1.陆军军医大学第一附属医院 检验科,重庆 400038;2.解放军第477医院 检验科,湖北 襄阳 441003
[摘 要] 目的 比较两台迈瑞BS380配套检测系统的性能评价结果,探讨国产生化分析系统的检测性能及应用中的质量控制。方法 分别参照EP5-A2、EP9-A2、EP6-A、EP7-A2和我国医药行业标准对两台使用年限在0.2年和3年的迈瑞BS380的16个常规生化项目进行精密度、方法学比对、分析测量范围、干扰实验和样本针携带污染率评价,并对两台仪器的评价结果进行比较。结果 两台BS380配套检测系统的方法学比对均未完全通过,虽然通过率差异无统计学意义(P=0.333),但是两台仪器未通过的项目并不相同;新装机的BS380在精密度、分析测量范围、干扰实验、样本针携带污染率等方面的性能均合格,而在基层医院使用3年后的BS380检测系统在多个方面的性能出现下滑,总精密度合格率为78.1%、抗干扰宣称符合率为83.8%、TBIL在宣称分析测量范围内线性欠佳。结论 国产生化分析仪的检测性能已能较好的满足临床需求,但即使是配套检测系统,为了实现结果的互认也必须进行方法学比对,并对未通过比对的项目进行正确度传递。在仪器使用过程中,检测性能必须定期进行评价,实时进行监控才可保证结果的有效性。
[关键词] 生化分析仪;性能评价;国产设备;质量控制;结果互认
引言
自1987年国务院先后批转国家计委和国家经委下发的《关于加速发展医疗器械工业的请示》和《关于发展医疗器械工业若干问题的通知》,提出医疗器械产业的全社会统筹规划和协调发展,从此,医疗器械产业迈入大发展时期。随着我国医疗器械市场的发展,国产医疗设备逐渐登上了历史舞台。生化分析仪是作为临床诊疗最基本、最常用的医疗设备,在我国医疗器械市场发展的浪潮中也脱颖而出。2003年,深圳迈瑞研发了我国第一台具有自主知识产权的全自动生化分析仪BS-300[1],随后国产生化分析仪陆续涌出,标示着我国医疗器械攻关技术实现了一项重大突破,打破了国外发达国家对自动化生化分析仪的技术和市场垄断[2]。目前,国产生化分析仪在国内外市场已经推广使用,性能得到了广泛的认可。但从我国的市场分布来看,国产生化分析仪市场份额仍然较低,且主要分布在中、小型医院[3]。在高喊提高基层医疗卫生服务质量和大力倡导实验室间结果互认的大环境下,基层医院的国产生化分析仪性能到底如何?与大型三甲医院在用的进口一线品牌是否具有较好的可比性呢?在此,分享国家科技支撑计划课题《基层生化设备应用评价研究》中两台迈瑞BS380的性能评价结果,对国产生化分析系统的检测性能及应用中的质量控制进行探讨。
1 资料与方法
1.1 检测系统
两台BS380为进行性能评价的仪器(此后分别称为BS380-1和BS380-2),使用年限分别为0.2年和3年,均为迈瑞配套检测系统,其中BS380-1安装于三甲医院实验室,BS380-2为基层医院在用的设备。与之进行方法学比对的设备均为大型三甲医院在用的进口生化分析仪,分别为奥林巴斯AU5400和西门子ADVIA2400配套检测系统,这两台作为参比仪器的生化分析仪性能经过了验证,室间质评结果优秀[4-5]。
1.2 试剂和样本
采用迈瑞配套检测试剂,统一使用同一批号的迈瑞质控品作为精密度评价的测试样本,购买部分难以获得高值血清项目的纯品(钙离子、血糖、尿素、无机磷、白蛋白、尿酸、肌酐)用于分析测量范围样本的配置以及胆红素和甘油三脂干扰物用于干扰实验。其他血清样本为当日送检的临床生化样本。
1.3 评价项目
在基层医院常规开展及未来5~10年预期开展的项目中选择了16个具有代表性的项目,兼顾了分析方法、多种检测原理、各路波长及对仪器挑战大的项目,如下:葡萄糖(GLU)、无机磷(P)、钙(CA)、尿素(UREA)、尿酸(UA)、肌酐(CREA)、甘油三脂(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、总蛋白(TP)、白蛋白(ALB)、直接胆红素(DBIL)、总胆红素(TBIL)。
1.4 评价方法
参照美国临床和实验室标准化协会(Clinical and Laboratory Standards Institutes,CLSI)颁布的 EP 文件和《中华人民共和国医药行业标准》,进行了精密度评价(EP5-A2)[5]、方法学比对(EP9-A2)[6]、分析测量范围(EP6-A)[7]、干扰实验(EP7-A2)[8]、样本携带污染率测试(行标)[9],详细步骤见《基层医院国产全自动生化分析仪的多中心现状调研与性能评价研究》[4]。
1.5 数据处理
利用Excle 2007进行数据汇总、分析,不同组间率或构成比采用卡方检验进行比较。采用SPSS 19.0进行统计分析,以P<0.05为具有统计学差异。
2 结果
2.1 精密度评价结果
采用不精密度表示,即同一实验室用同种方法在多次独立检验中分析同一样品所得结果的离散程度。以每批连续两次测定的差值为批内差,用批内差统计结果反映仪器的批内不精密度;以一天两批均值的差值为当天的批间差,批间差的统计结果去掉其中批内差成分即为批间不精密度;以每天4个测试结果均值间的差异为天间差,天间差的统计结果去掉其中批间差成分即为天间不精密度。批内不精密度、批间不精密度及天间不精密度以方差形式相加反映总不精密度。以美国临床实验室改进修正法规’88(The Clinical Laboratory Improvement Amendments of 1988,CLIA’88)为判断标准,批内精密度≤±1/4 CLIA’88允许总误差为合格,总精密度≤±1/3 CLIA’88允许总误差为合格。BS380-1和BS380-2批内精密度均合格,总精密度前者均合格,后者的合格率仅为78.1%,两者总精密度合格率差异有统计学意义(P=0.016),结果详见表1。
表1 精密度评价结果分析表
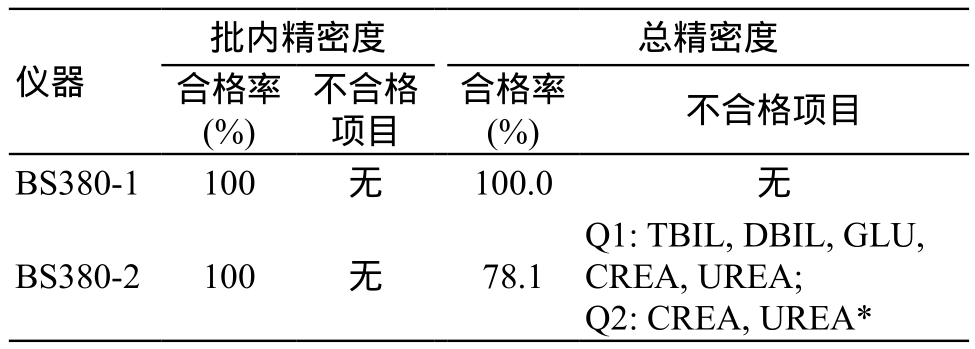
注:*表示Q1为低值水平,Q2为高值水平。
2.2 方法学比对结果
以大型三甲医院中全国室间质评优秀,性能评价合格的配套检测系统为参比系统,以参比系统和待评系统拟合方程的斜率在0.9-1.1之间且R2>0.95为拟合方程比对通过,以我国卫生行业标准(WS/T403-2012)《临床生化化学检验常规项目分析质量指标》的总误差为质量目标,医学决定水平处偏差小于卫生行业标准为医学决定水平处比对通过。16个评价项目中,BS380-1和BS380-2都只有14个项目通过了拟合方程比对,通过率均为87.5%。在医学决定水平处,BS380-1和BS380-2比对通过率仍无显著性差异(83.7%和90.7%,P=0.333),但两台仪器未通过比对的项目不尽相同,结果见表2。
2.3 分析测量范围结果
根据行业要求,评价项目在宣称的线性范围内结果应呈线性分布,即相关系数R>0.99,线性偏差≤±10%。BS380-1所有项目的评价浓度均覆盖了宣称的线性范围,且所有项目在评价的浓度范围内符合线性分布。BS380-2部分项目的评价浓度未覆盖宣称范围,但已经涵盖临床样本可见的浓度范围。在评价的浓度范围内,除TBIL未达到要求外,其余项目均满足线性分布。
表2 方法学比对结果分析表

2.4 干扰实验结果
在厂家宣称的抗干扰浓度范围,检测结果相对偏差≤±10%即为符合宣称。BS380-1宣称符合率为100%,BS380-2仅为83.8%,不符合宣称项目为胆红素干扰:ALT,AST;血红蛋白干扰:ALT,UREA;甘油三脂干扰:ALT,DBIL。差异有统计学意义(P=0.033)。
2.5 样本针携带污染率结果
样本针携带污染率<0.5%为合格。BS380-1和BS380-2携带污染率分别为0.27%和0.32%,均合格。
3 讨论
生化分析仪作为临床最基本的检验诊疗设备,其性能受到广泛关注。对实验室在用的生化设备进行性能评价主要包括硬件性能和检测性能两个方面。前者主要是指行业标准YY/T 0654-2008《全自动生化分析仪》中规定的设备杂散光、吸光度准确性与稳定性、加样准确性与重复性、温度准确性与波动度、携带污染率等仪器的基础硬件性能[10],后者则是指仪器及其试剂、操作程序等组合成的检测系统[11]的精密度、准确性、分析测量范围、抗干扰能力、可报告范围等实际检测过程中可体现的综合性能。由于检测性能是临床生化结果有效性的直接体现,生化分析仪的性能评价多是针对检测系统的检测性能评价[12]。对于检测性能评价,国内尚没有统一标准,国际上以CLSI颁布的EP文件作为参照,国内生化分析仪的评价大部分也是参照这个标准进行[13]。但是由于EP文件要求严苛,在繁忙的临床实验室里几乎难以完全实现,各种“简化版”的性能评价随处可见。本研究是基于国家科技支撑计划项目的多中心研究课题,参照EP文件并结合现实条件对评价方案进行了细化,实验设计科学、严谨,由大型三甲医院牵头,统一了试剂和评价流程,并由专人负责完成整个评价过程,所获得的结果可靠并具有较好可比性。本文展示了其中两台BS380的评价结果,其中BS380-1为安装在三甲实验室的全新设备,可代表该设备出厂时的性能状态,BS380-2为基层医院使用了3年的设备,可反映该设备实际使用过程中的性能现状。这两台BS380均为配套检测系统,消除了由试剂带来的性能偏差,具有较好的“本底一致性”。从评价结果可以看出,BS380-1检测系统的性能评价结果明显优于BS380-2,主要体现在精密度、分析测量范围和抗干扰能力等方面。由此可见,即使是相同品牌同一型号的配套检测系统,实验室环境、操作程序、使用年限等影响因素不同检测性能也不尽相同。精密度是生化分析仪最基础的性能,认真分析BS380-2精密度的原始数据发现,在精密度评价的第二天出现了多个项目结果同时偏低的现象,在保持较好批内精密时却严重影响了部分项目的总精密度,从而导致了其总精密度严重下降。除去上述“偶发”现象,BS380-2精密度也还算优良。总体来说,迈瑞BS380出厂性能确实过硬,完全可以满足临床的检测需求,但在基层医院使用过程中稳定性还有待考量,性能有下滑现象。不可否认,随着仪器使用年限的增加,硬件损耗难免,若未做好日常维护保养,性能必定快速下滑。因此,基层医院在做好日常维护保养的同时有必要进行每日的室内质控和定期的性能评价,保持对仪器精密度的监测和实际分析测量范围、抗干扰能力、可报告范围等性能的了解,而非盲目参照厂家宣称的性能。
为了实现不同省市、不同医院间的结果互认,全国范围内和省市范围内的室间质评从评价项目到覆盖面积都不断扩展。但是值得注意的是,很多实验室中相同检测项目常有多套不同的检测系统,而参加室间质评的检测系统仅仅是其中一台。为了保证实验室所有检测系统的可比性,我们可将室间质评结果优秀的检测系统作为基准仪器,其余检测系统与之进行比对的方式进行正确度验证。本文就是采取这样的理论将两台迈瑞BS380分别与准确性得到确认的进口一线品牌进行了方法学比对。深圳迈瑞作为国内起步较早的医疗设备制造商,其生化设备在国内外广泛推广应用,代表了国内生化设备的先进生产水平。迈瑞配套生化检测系统经过了严格的溯源,在理论上已具备较好的准确性,但两台BS380仍都有部分项目未通过比对。虽然两台仪器的比对通过率差异无统计学意义,但未通过比对的项目并不相同。配套检测系统因为具有较好的溯源性和稳定性而被推崇,而我们的结果表明即便是配套检测系统间,为了保证结果的一致性也必须进行有效的方法学比对,这与本课题前期的报道相一致[14]。目前,各级医院采用自建生化检测系统的实验室尚多,检测系统的准确性更难以保障。笔者认为,在积极参与室间质评的基础上,定期进行有效的方法学比,并针对比对不通过的项目用新鲜血清进行正确度传递不失为确保结果互认的可行方式[15-16]。
生化分析仪的生产工艺已经成熟,无论是进口设备还是国产品牌都已能较好满足临床需求,为各级医院检验结果的互认提供了硬件基础。各级医院实验室若能强化质量意识,积极参与室间质评,定期进行性能评价,重视仪器间结果的比对分析,实现结果互认便不再是难事,而医疗卫生服务质量也必定会得到提高。
[参考文献]
[1] 姚鹏飞.BS300全自动生化分析仪的自动化实现[D].西安:西安电子科技大学,2002.
[2] 袁启明.自动化生化分析仪的发展及市场概况[J].上海食品药品监管情报研究,2006,(4):32-34.
[3] 刘跃平,徐含青,李明,等.参与课题组医院基本信息统计[A].2014中国医疗设备民族工业发展大会征文集[C].2014.
[4] 徐含青.基层医院国产全自动生化分析仪的多中心现状调研与性能评价研究[D].重庆:第三军医大学,2016.
[5] Tholen DW,Kallner A,Kennedy JW,et al.Evaluation of precision performance of quantitative measurement methods; approved guideline—second edition[J].Evaluation,2004,24(25).
[6] NCCLS document EP9-A2,Method comparison and bias estimation using patient samples; approved guideline—second edition[S].2002.
[7] Clsi.EP6-A,Evaluation of the linearity of quantitative measurement procedures: A statistical approach; approved guideline[S].2003.
[8] Clsi.EP7-A2,Interference testing in clinical chemistry.Approved guideline-second editiion[S].2005.
[9] 国家食品与药品监督管理局.YYT 0654-2008全自动生化分析仪行业标准[S].2008.
[10] 王远,严荣国.基于行业标准的国产美康MS-880全自动生化分析仪性能评价[J].国际检验医学杂志,2015,36(14):2103-2105.
[11] 冯仁丰.医学实验室质量管理技术基础[M].北京:人民卫生出版社,2003:83.
[12] 陈海明,王前明,赵元勋.日立7600全自动生化分析仪的分析性能验证[J].国际检验医学杂志,2015,36(20):2983-2986.
[13] 曹锋,陈炜.ADVIA 2400全自动生化分析仪性能验证[J].国际检验医学杂志,2015,(1):120-121.
[14] 徐含青,刘跃平,府伟灵,等.“迈瑞”全自动生化分析仪的偏倚评估研究[J].第三军医大学学报,2016,(9):997-1002.
[15] 王梅英.东芝TBA2000FR全自动生化分析仪检测质量控制探讨[J].中国卫生标准管理,2017,8(25):101-102.
[16] 张秀明,李炜煊,蓝锴,等.自建生化检测系统的量值溯源性和可比性研究[J].检验医学,2007,22(3):299-303.
Comparison of Analytical Performances of Two Mindray 380 Auto Biochemistry Analyzers
XU Hanqing1, LIU Yueping1,2, FU Weiling1, HUANG Junfu1, WEI Kun1, YANG Xiang1, HUANG Qing1
1.Department of Laboratory Medicine, The First Affiliated Hospital of Army Medical University, Chongqing 400038, China;2.Department of Laboratory Medicine, 477 Hospital of PLA, Xiangyang Hubei 441003, China
Abstract: Objective The aim of this study was to compare analytical performances of two Mindray 380 auto biochemistry analyzers using matching reagents and to discuss analytical performances of domestic biochemistry analyzers and their quality control during application. Methods Durable years of the two analyzers were 0.2 year (BS380-1) and 3 years (BS380-2), respectively. Precision,methodological comparison, linearity and interference of 16 common tests and sample needle carryover effects were evaluated according to CLSI protocols EP5-A2, EP9-A2, EP6-A, EP7-A2 and China’s pharmaceutical industry standard, respectively. Then results were compared between these two analyzers. Results Results of methodological comparison were not totally passed, though pass rates were not statistically significant (P=0.333). In addition, tests that were not passed were not the same; BS380-1’s precision,linearity, interference and sample needle carryover effects all passed while BS380-2’s did not perform well in the aspects of precision, interference and linearity. Results were as follows: Qualified rates of total precision was 78.1%, coincidence of proposed anti-interference was 83.8%, and linearity of TBIL was not as good as manufacturer’s statement. Conclusion Domestic analyzer is suitable for its utilization in modern clinical laboratories. In order to realize results inter-accreditation, methodological comparison and accuracy transfer are needed even matching reagents are used. Also, periodic evaluation of analytical performances and real-time monitoring are awaited in order to guarantee effectiveness of results.
Key words: biochemistry analyzer; evaluation of performance; domestic equipment; quality control; results inter-accreditation
[中图分类号]R446.11;TH789
[文献标识码]B
doi:10.3969/j.issn.1674-1633.2018.05.025
[文章编号]1674-1633(2018)05-0093-04
收稿日期:2017-06-14
修回日期:2017-07-19
基金项目:国家科技支撑计划课题(2013BAI17B04)。
通讯作者:黄庆,主任医师,主要研究方向为分子诊断和设备应用评价。
通讯作者邮箱:Dr.Q.huang@gmail.com
本文编辑 袁隽玲