基于DTI图像的脑干肿瘤术前路径自动规划设计
李苗1,刘佳1,泮长存2,汤劼2,张力伟2,廖洪恩1
1.清华大学 医学院生物医学工程系,北京 100084;2.首都医科大学附属北京天坛医院 神经外科,北京 100050
[摘 要]目的本研究提出基于磁共振弥散张量成像(Diffusion Tensor Imaging,DTI)图像的脑干肿瘤术前路径自动规划设计,对重要组织结构的有效规避和减少手术致残率具有重要意义。方法本研究将DTI功能像与核磁共振结构像相结合,进行脑干肿瘤术前路径自动规划。首先对DTI图像进行变形矫正,将DTI功能像与核磁共振结构像进行配准,然后提取两种图像的关键区域信息,利用引力斥力模型通过样条曲线插值对术前信息进行路径自动规划设计。结果该方法提取术前的纤维束与组织结构信息,完成术前自动路径规划,直观的实现了对关键组织最大化规避的路径规划设计。结论该方法通过对术前DTI图像的矫正配准以及区域纤维束的追踪提取,为医生在术中规避重要组织区域提供直观信息。
[关键词]弥散张量成像;脑干肿瘤;图像配准;纤维束;路径规划
引言
脑干肿瘤手术难度极大,主要是因为脑干区域结构复杂,而且脑干是神经系统的中枢,脑干病变与核团、神经传导束关系密切。许多神经核团、纤维束和网状结构等都集中在一个较小的区域,在手术过程中容易误伤这些重要组织,因而脑干肿瘤手术困难较大,易造成脑干内的重要结构损伤,手术致残及手术死亡率较高,而且容易发生预后不良等状况。
手术导航系统(Image Guided Surgery,IGS)对临床手术作用显著,据相关临床数据能提高病灶切除率(86.7%),降低手术并发症(12.1%)和死亡率(0.8%),临床疗效卓越[1-2]。手术导航系统中一个十分重要的部分就是路径规划,目前也有很多关于路径规划的研究,如常用的点辖域[3]规划方法需要医生在常规二维断层图像上勾画重要组织区域建立点辖域,然后根据这些区域建立路径。该方法考虑了在手术过程中部分关键结构对手术路径的影响,但是关键的区域还是需要通过医生在二维断层图像上进行勾画选择。有文献提出通过机器学习[4-5]的手段根据医生的经验学习医生的路径规划方式,但这个方式往往需要大量的样本数据来保持准确性。有文献提出通过快速自适应分形树[6-7]的方式来进行三维空间路径规划,该方法通过硬件加速实时性较强,但传统的手术导航系统在进行路径规划时往往仅考虑核磁共振成像(Magnetic Resonance Imaging,MRI),没有办法评估脑干肿瘤手术中细微结构对手术路径的影响。
磁共振弥散张量成像(Diffusion Tensor Imaging,DTI)通过探测人体内部水分子弥散情况来反应细微结构的变化,因此能够有效无损辨识微细结构中的病变组织[8]。DTI一般釆用平面回波成像序列(Echo-Planar Imaging,EPI)[9],该成像对梯度磁场要求较高,图像容易发生畸变,因此在应用DTI图像前需要进行预处理完成畸变矫正。最近研究[10-13]表明DTI能为医生提供纤维束分布信息,有助于辅助医生完成术前规划,减少手术损伤。
本文提出将DTI功能像与MRI结构像相结合,完成脑干肿瘤术前路径自动规划设计,通过对术前DTI影像数据的分析处理,自动规划手术路径,引导医生在术中规避重要组织区域,减少手术风险。
1 方法与原理
本研究提出了基于DTI图像的脑干肿瘤术前路径自动规划设计,其主要流程见图1,主要包括3个部分:① 术前DTI图像畸变矫正并与MRI结构像配准;② 完成纤维束重建及组织模型分割并提取重要组织关键位置信息;③建立模型并利用贝塞尔曲线插值通过关键控制点完成术前路径自动规划。

图1 手术路径自动规划系统流程
本研究通过结合术前DTI功能像以及MRI结构像,建立引力斥力模型完成自动路径规划设计,为医生在术中规避重要组织区域提供参考。
1.1 术前DTI图像处理
术前DTI图像处理主要分成以下4个步骤:① DTI图像转变为标量图像,通过提取张量信息中能反应各向异性信息的特征值完成;② 获取MRI图像的标量信息,通过最大互信息匹配找到标量图像间的映射关系T;③ 根据映射关系T对DTI图像变换张量的位置;④ 张量重定向得到配准结果。
张量图像配准需要提取出能反应某种特性的相似性度量标量,将张量图像转换为标量图像以后再进行配准。反应扩散各向异性的特征量主要有[14-15]:扩散张量的迹(Trace)、部分各向异性(Fractional Anisotropy,FA)、相对各向异性(Relative Anisotropy,RA)。Trace反应了总体扩散程度,这个特征量可用于辅助脑溢血与脑外伤的诊断。FA代表的是张量的各向异性程度,RA能够表达和描述张量的各向异性是如何分布的,是一种较好的反应脑组织的分布图像。本文通过提取以上3种相似性度量标量来完成标量图像的匹配。
接着根据提取得到的标量信息值通过最大互信息配准[16],将DTI图像与MRI结构像进行配准,其主要方法如下:图像DA和DB的互信息值定义为:
其中A、B分别代表DTI以及MRI,p (ak,bj)为两种图像的联合灰度概率分布,我们取两种图像的互信息最大值时的映射关系T为最佳配准关系。
得到映射关系T后我们将矩阵相乘就可以得到变换后的图像。最后,本研究通过有限张力法(Finite Stain,FS)[17]完成张量重定向。
这部分我们建立了DTI图像与MRI结构像的对应关系,然后我们需要根据这两种图像提取关键位置信息。
1.2 术前重要组织区域关键位置信息提取
重要组织区域的关键信息提取主要针对脑干区域组织结构模型以及纤维束两个部分。本研究通过对上述两个部分提取关键位置信息数据来完成下文的自动路径规划研究。层次包围盒方法[18-20]是碰撞检测算法中常用的一种方法,该方法主要是将对象以包围盒的形式建立相对简单的模型数据,根据包围盒之间的相交检测实现快速精准碰撞检测。由于组织结构点云数据庞大,而且分布不具备规律性,实时追踪比较困难,因此本文采用构建包围盒模型,通过包围盒来控制模型范围,提取模型的边界位置,然后通过这些位置信息实现实时检测手术路径与重要区域的碰撞情况,避免对重要区域的损伤。
本研究通过对脑干分割组织进行包围盒构建以及对追踪得到的纤维束信息进行边缘信息提取获取重要区域的关键信息位置,其主要流程,见图2。该方法主要利用VTK工具包编程实现,对纤维束的追踪过程则主要通过开源软件3D Slicer辅助完成。
1.3 手术导航路径自动规划设计
在路径规划的设计过程中,主要有两个重要的因素:一是路径的距离;二是路径经过的重要结构组织。因此,我们根据以上两点自动设计手术路径,当然医生也可以根据实际情况对自动设计的路径进行再次调整,两者结合完成最终的路径规划设计。

图2 模型关键信息提取
我们采用传统物理学中的引力和斥力代表手术路径的距离和手术路径经过的重要结构组织[21],其中引力的大小代表距离风险的大小,斥力的大小代表脑干区域重要组织带来的风险大小。其具体的模型为:
(1)引力模型:
其中d为手术入路到目标区域的距离,当距离越短时,相对应的引力越大,对脑干结构组织伤害越小;反之,当距离越远时,引力也越小,伤害也就越大。这里面的k设置为系数,k用来调整曲线的形状。当k越大,曲线越陡,所代表的意思为手术入路与目标区域之间的距离与引力大小的变化关联程度上升。医生可根据实际情况对k的值进行相应的调整。
(2)斥力模型:
其中s为手术路径到脑干附近重要组织结构的距离,当s越小,相对应的斥力越大,对脑干附近重要组织结构伤害也越大。λ1和λ2为两种不同重要组织对受力的影响系数,代表脑干附近组织模型以及纤维束区域对手术路径的影响程度。因此整体的路径设计就是:
代表引力与斥力之差求极值的过程。式中hg和hr分别代表两种力对于路径设计的影响程度。
令hr=0,则上式对于路径设计仅考虑距离影响,而在脑干肿瘤手术过程中手术进入点以及目标靶区域可以认为是已知,那么可以计算求取得到引力最小值fg0,此时所得到的路径为手术入路到目标区域的直线,中间会与重要组织发生碰撞。
令hg=0,则上式对于路径设计仅考虑组织因素影响,通过样条曲线插值可以计算求取得到斥力最小值fr0,此时所得到的路径为能避开重要组织的样条曲线,但路径整体距离较大。
因此对两种互斥力极值求解可以转化为系数h对力f对的影响关系。根据一种改进的粒子群算法,可建立如下的模型:
式中hmin和hmax分别为系数的最小值和最大值,fmin和favg分别为当前力的最小值与平均值。
通过对系数值h的估计以及对引斥力的求解,我们可以得到手术路径的两个核心构成部分:手术入路到目标区域的距离以及手术路径与重要组织结构距离的最优解。我们通过这两个部分构建3次贝塞尔曲线插值完成路径规划设计:
本研究通过对脑干区域重要组织提取关键位置信息并构建模型完成自动路径规划,有助于医生在术中规避重要区域,减少组织损伤。
2 实验结果
本研究数据来源为首都医科大学附属北京天坛医院,针对20例脑干肿瘤患者进行了扫描。扫描设备为Philips Achieva 3.0T TX磁共振成像系统。T1序列主要扫描 参 数:TR=7.6 ms,TE=3.7 ms,Matrix=256×256,Thickness=2 mm,PixelSpacing=0.9×0.9 mm;DTI序 列 主 要 扫 描 参 数:TR=8464.6 ms,TE=70.1 ms,Matrix=256×256,Thickness=2.2 mm,b=1000 s/mm2。
本研究从3个方面对结果进行评估,首先对术前DTI图像进行处理,实现DTI功能像与MRI结构像融合,接着提取术前重要组织关键位置信息,最后根据这些关键位置信息建立模型实现自动路径规划。
2.1 术前DTI图像处理
我们通过对DTI图像进行张量分解,提取得到特征标量图见图3,然后将分解得到的图像与同为标量数据图像的MRI结构像进行去畸变配准。
通过对DTI图像的张量分解,我们提取出可以代表张量数据信息的特征标量值,为下一步标量图像的配准做好准备。在张量分解之后,我们通过对标量数据完成基于最大互信息的标量图像配准,我们得到两种序列之间的转换矩阵。利用该转换矩阵,我们将DTI图像与MRI结构像进行了结合,其结果见图4。医生能在获取MRI结构像的同时获取DTI图像的信息,在规避重要组织时医生可以同时考虑两种图像所提供的信息,减少手术损伤。
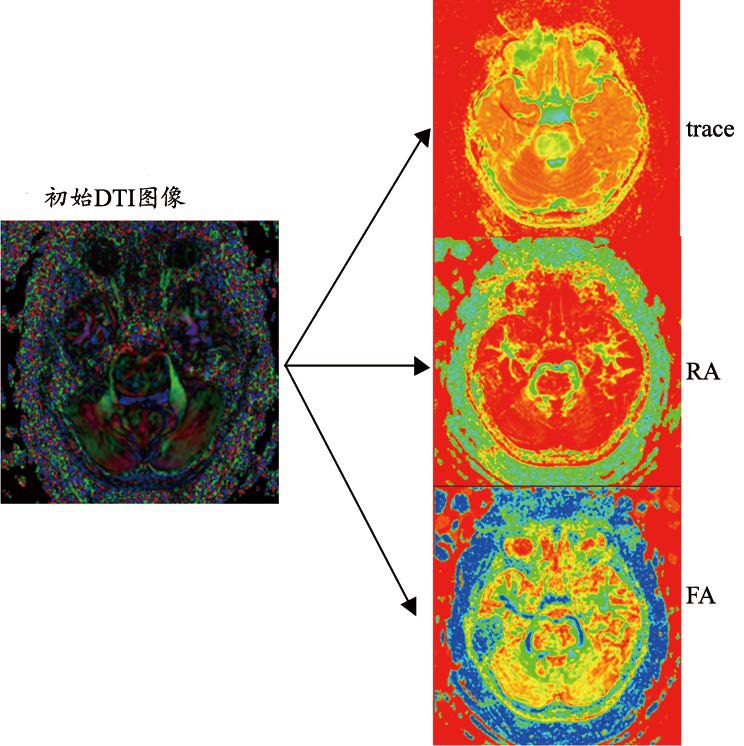
图3 DTI张量分解

图4 DTI功能像与MRI结构像融合
2.2 术前重要组织区域关键位置信息提取
我们通过对DTI图像进行脑干附近纤维束追踪,追踪结果见图5。通过纤维束追踪,医生可以直观的从DTI图像中观察到三维立体的纤维束数据。纤维束作为脑干肿瘤手术中容易发生损伤的重要组织,我们将其三维立体可视化,并且在手术路径的自动规划中考虑纤维束对路径的阻挡因素,便于医生规避手术风险。
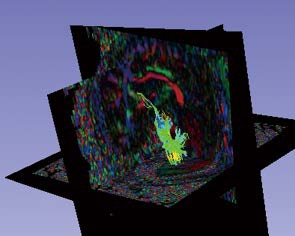
图5 纤维束追踪
通过对模型进行包围盒构建,我们可以实时快速的提取模型数据的边缘信息,将复杂的体数据简化为包围盒模型,加入到自动路径规划算法之中,使得自动路径规划快速有效,其结果见图6。

图6 组织结构包围盒模型构建
2.3 手术导航路径自动规划设计
本方法基于vs2010与VTK、ITK混合编程,采用Qt作为界面设计的工具,实现了导航界面的初步开发,主要按照导航的基本流程完成了相关的功能设计,结合术前的DTI图像,追踪感兴趣区区域的纤维束结构,实现多序列信息的术前融合,根据术前多序列影像智能设计手术路径以及在术中对危险区域进行预警,减少手术风险。其主要界面见图7。

图7 手术导航程序界面
根据术前分割得到的组织结构以及纤维束信息,实现手术路径自动设计,医生可以根据自动路径引导来有效规避重要组织。
2.4 结果评估
本方法根据术前MRI结构像以及DTI图像,分割得到脑干组织结构信息以及纤维束信息,通过对组织结构建立包围盒以及对纤维束提取边缘信息的方式,通过引斥力模型自动设计手术路径,为医生在术中规避重要组织区域提供参考。传统的手术路径设计方法往往仅考虑手术入路的选择,需要医生在手术中借助自身经验,根据实际情况调整手术路径来完成手术。两个不同患者在传统手术路径与本文提出的根据术前DTI图像自动规划路径进行的对比,见图8,图中白色直线为传统手术路径,淡红色曲线为本文提出的参考手术路径。从图中可以看出本文提出的自动路径规划设计对重要组织进行了规避。

图8 传统手术路径与自动设计路径对比
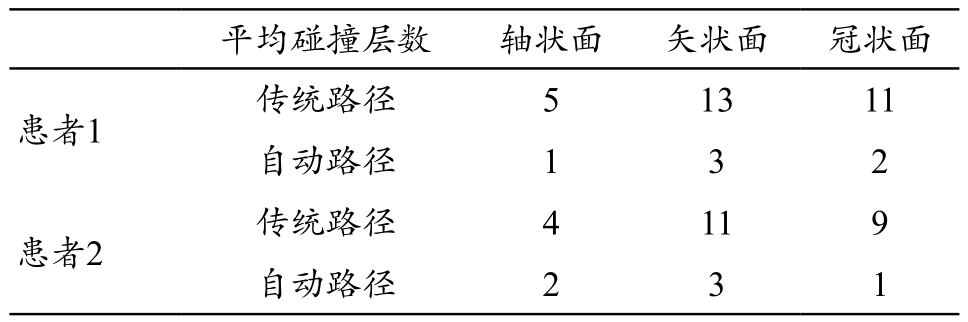
本文通过将手术路径投射到二维平面,以手术路径与组织信息以及纤维束结构发生碰撞所占用的二维切面数作为本方法的定量评估,具体见表1,可以看出本方法提出的自动路径规划设计对重要组织区域的碰撞层数在3个方向下降都较为明显,因此本方法有助于医生规避重要组织区域。
表1 传统手术路径与自动设计路径组织碰撞层数
3 讨论
本文针对脑干肿瘤手术临床问题,提出基于DTI图像的自动路径规划设计通过对术前影像数据的分析处理,为医生在脑干肿瘤手术中规避脑干区域重要组织区域提供引导。但本文提出的方法仍存在局限性,首先该方法采用的均是术前图像,并没有考虑到术中变形问题;另外由于算法的实时性问题,在自动设计路径时对边缘设计包围盒时仍不够精确,在对纤维束追踪过程中使用了开源软件可能也引入了误差。而且自动设计的路径在临床实用性上需要进一步考虑,后续研究可以考虑引入术中变形配准,自动路径算法的实时精确设计以及在临床操作中的可行性分析。
4 结论
本研究通过对DTI图像进行畸变矫正,将其与MRI结构像相配准,然后根据从DTI图像追踪得到的纤维束信息与MRI结构像分割得到的结构信息完成基于包围盒理论、引力斥力模型与贝塞尔曲线插值的术前路径自动规划设计。下一步的研究任务可以在本研究的基础上设计术前手术模拟,根据自动规划路径设计模拟手术,提高医生手术完成质量。
[参考文献]
[1] 周良辅.神经外科导航学[M].上海:上海科技教育出版社,2008.
[2] 刘伟,樊宽章.手术导航技术[J].中国医疗设备,2003,18(7):5-7.
[3] 李修往.一种颅脑外科手术路径规划系统的研制[J].中国医疗器械杂志,2000,24(1):1-5.
[4] Liu Y, Dawant BM,Pallavaram S,et al.A surgeon specific automatic path planning algorithm for deep brain stimulation[A]. Medical Imaging 2012 Image-Guided Procedures, Robotic Interventions, and Modeling[C].San Diego,California,USA:IEE E,2012:83161D-83161D-10.
[5] Liu Y,Li S,Xia Z.Path planning efficiency maximization for ball-picking robot using machine learning algorithm[A]. ICITBS 15 Proceedings of the 2015 International Conference on Intelligent Transportation,Big Data & Smart City (ICITBS)[C]. Seattle,WA,USA:IEEE,2015:551-555.
[6] Éderson D,Albakri A,Zemiti N,et al.Simplified adaptive path planning for percutaneous needle insertions[A].2015 IEEE International Conference on Robotics and Automation (ICRA)[C]. Seattle,WA,USA:IEEE,2015:1782-1788.
[7] Liu F,Garriga-Casanovas A,Secoli R,et al.Fast and adaptive fractal tree-based path planning for programmable bevel tip steerable needles[J].IEEE Robot & Auton Letters,2016,1(2): 601-608.
[8] 林涛.基于k-medoids聚类的人脑DTI图像分割算法及其纤维追踪的研究[D].上海:上海师范大学,2016.
[9] Le BD,Poupon C,Amadon A,et al.Artifacts and pitfalls in diffusion MRI[J].JMRI,2006,24(3):478.
[10] Pujol S,Wells W,Pierpaoli C,et al.The DTI challenge: toward standardized evaluation of diffusion tensor imaging tractography for neurosurgery[J].J Neuroimaging,2015,25(6): 875-882.
[11] Asato MR,Terwilliger R,Woo J,et al.White matter development in adolescence: a DTI study[J].Cereb cortex,2010,20(9):2122-2131.
[12] Engwer C,Hillen T,Knappitsch M,et al. Glioma follow white matter tracts: a multiscale DTI-based model[J].J Math Biol,2015,71(3):551.
[13] Anthofer JM,Steib K,Fellner C,et al.DTI-based deterministic fibre tracking of the medial forebrain bundle[J].Acta Neurochir,2015,157(3):469-477.
[14] 姚旭峰.神经导航中磁共振弥散张量图像处理技术的研究[D].北京:复旦大学,2011.
[15] 韦芳芳.基于扩散张量图像的配准算法研究[D].上海:上海师范大学,2013.
[16] Savadjier P,Kindlmann G,Bouix S,et al.Local white mattergeometry indices from diffusion tensor gradients[J].Neuro Image,2010,49(4):3175-3186.
[17] Takao H,Hayashi N.White matter asymmetry in healthy individuals: a diffusion tensor imaging study using tract-based spatial statistics[J].Neuroscience,2011,193(10):291-299.
[18] Adelson SJ,Hodges LF.Generating exact ray-traced animation frames by reprojection[J].IEEE Comput Graph Appl,1995, 15(3):43-52.
[19] 王晓荣.基于AABB包围盒的碰撞检测算法的研究[D].武汉:华中师范大学,2007.
[20] Liu J,Chen J.3D Collision detection algorithm based on composite balanced binary bounding box Tree[J].Comput Med,2016:646-650.
[21] 陈宇.基于肺穿刺手术导航的精度提升与路径规划研究[D].秦皇岛:东北大学,2014.
本文编辑 王静
Design of Automatic Preoperative Path Planning of Brain Stem Tumor Surgery Based on DTI
LI Miao1, LIU Jia1, PAN Changcun2, TANG Jie2, ZHANG Liwei2, LIAO Hongen1
1.Department of Biomedical Engineering, School of Medicine, Tsinghua University, Beijing 100084, China;2.Department of Neurosurgery, Beijing Tian Tan Hospital, Capital Medical University, Beijing 100050, China
Abstract:ObjectiveWe proposed an automatic preoperative path planning method based on diffusion tensor imaging (DTI) for brain stem tumor surgery to effectively circumvent the important organizations and reduce the disability rate.MethodsIn this paper, DTI and magnetic resonance imaging (MRI) were combined effectively for the automatic preoperative path planning of brain stem tumor surgery. Firstly, DTI was corrected and registered with MRI. Then, the key region information of these two modal images was extracted for automatically designing the surgical path with gravity repulsion model and spline interpolation.ResultsOur method could complete automatic preoperative path planning through extracting the information of preoperative fiber bundle and tissue structure. In additional, it could realize the path planning intuitively and maximize avoid important tissue damage.ConclusionThe proposed automatic preoperative path planning method based on the preoperative DTI can provide intuitive information for the doctors to avoid important tissue damage.
Key words:diffusion tensor imaging; brainstem tumor; image registration; fiber bundle; path planning
[中图分类号]R445.2
[文献标识码]A
doi:10.3969/j.issn.1674-1633.2017.08.014
[文章编号]1674-1633(2017)08-0055-05
收稿日期:2017-05-02;
修回日期:2017-05-26
基金项目:国家自然科学基金(81427803);北京市科委生命科学领域前沿技术专项(Z151100003915079);北京市自然科学基金资助项目(7172122)。
通讯作者:廖洪恩,教授,博士研究生导师。
通讯作者邮箱:liao@tsinghua.edu.cn