量子点复合微球的活体荧光和化学发光双模式成像
叶一1,王国武1,王莉萍1,和田智之2,王瑾晔1
1.上海交通大学 生物医学工程学院,上海 200240;2.日本理化学研究所 先进光子学中心,和光 埼玉 351-0198
[摘 要]为了探索荧光/化学发光双模式成像方法用于可降解生物材料研究的可行性,将载有量子点的可降解高分子微球(量子点复合微球)植入小鼠背部皮下,利用美国Caliper定量荧光和生物发光成像系统IVIS Lumina II观察不同时间点植入部位的荧光强度和L-012介导的化学发光强度的变化。结果显示:30 mg量子点复合微球植入28 d时,仍能检测到荧光信号。L-012介导的化学发光强度随时间逐渐减弱,第28 d时,量子点复合微球处仍存在微弱的化学发光。
[关键词]量子点;复合微球;活体荧光成像;活性氧;化学发光
引言
量子点是一种具有纳米尺寸的无机半导体荧光染料[1],与传统的有机荧光染料相比,量子点具有良好的光稳定性,发射波谱窄而对称,吸收波谱较宽的特点[2]。1998年Alivisatos[3]研究小组和Nie[4]研究小组在Science上同时报道了量子点应用于细胞及组织标记成像的研究成果,因此量子点及其交联物已被成功运用于各种成像应用,包括标记固定细胞、动态观察活体细胞、荧光探测及活体动物成像。Jie等[5]研究CdTe/CdS/ZnS在动物皮下、尾静脉、肌肉注射活体成像效果,其荧光量子转化率高,动物自体荧光对量子点荧光的干扰小。
但是,由于量子点本身含有重金属,具有一定的毒性,在生命科学领域的研究仍局限于实验室,临床应用尚未推广[6-7]。因此,利用其他天然或者合成材料包裹量子点,能够有效的增强量子点的生物相容性[8-9]。Kim等[10-11]利用透明质酸与量子点交联形成复合物注射到小鼠背部皮下,小鼠存活超过2个月,且透明质酸-量子点复合物产生的荧光在2个月时仍然能被检测到。
为了实现荧光和化学发光的双模式活体成像,本研究将量子点吸附在可降解高分子微球中,然后注射到小鼠背部皮下,利用化学发光探针L-012[12]检测小鼠体内对生物材料表面响应产生的活性氧[13],通过定量荧光和生物发光成像系统实时同步观测皮下荧光位置和强度变化。
1 材料与方法
1.1 实验材料
健康Balb/c小鼠 3只,清洁级,年龄6周,体重18~22 g,雌性,购于上海斯莱克实验动物有限责任公司,由上海交通大学实验动物中心提供。水溶性量子点CdSe/ZnS QDs被MPA(3-巯基丙酸)包覆,溶解于PBS,发射波长为650 nm,水合粒径约10~12 nm,购自苏州星烁纳米科技有限公司。L-012化学发光探针购自Wako(日本和光纯药工业株式会社)。
1.2 实验仪器
日本OLYMPUS荧光倒置显微镜,型号IX-71;美国Caliper定量荧光和生物发光成像系统,型号IVIS Lumina Ⅱ。
1.3 实验方法
1.3.1 量子点复合微球制备
将可降解高分子微球避光浸泡于5 nmol/mL 量子点溶液中,24 h 37℃恒温吸附达饱和后,吸去量子点溶液。用无菌PBS浸泡5 min洗去未吸附量子点,反复清洗直至PBS浸泡液荧光强度稳定,得到量子点复合微球(QD/ BPM),无菌保存于4℃冰箱。
1.3.2 体外荧光与化学发光成像实验
使用Caliper定量荧光和生物发光成像系统,在黑底 96孔板中进行体外化学发光成像预实验。0.05 mmol/L过氧化氢溶液中加入50 mmol/L L-012溶液,对比20 nmol/mL量子点溶液加入前后的化学发光,溶液体系见表1。
表1 体外成像实验溶液体系 (单位:μL)
1.3.3 量子点复合微球动物体内双模式成像实验
动物腹腔注射1%戊巴比妥钠50 mg/kg麻醉后,在小鼠背部皮下不同位置植入300 μL PBS,10、20、30 mg量子点复合微球(10-QD/BPM,20-QD/BPM,30-QD/BPM)。
利用Caliper定量荧光和生物发光成像系统进行荧光成像,激发波波长为410 nm,发射波滤光片可接受光波长范围为575~650 nm,成像过程中使用异氟烷进行气体麻醉。化学发光成像前腹腔注射100 μL L-012溶液(15 mg/mL),不同时间点进行化学发光成像。
2 结果
利用荧光倒置显微镜可以观察到可降解微球在吸附量子点前后的荧光变化,激发光波长为330~385 nm。在吸附量子点前,微球载体有自发荧光;吸附量子点后得到的量子点复合微球显现出明亮的红色荧光,见图1。

图1 微球荧光图像
注:a.可降解微球的自发荧光;b.量子点复合微球的荧光。
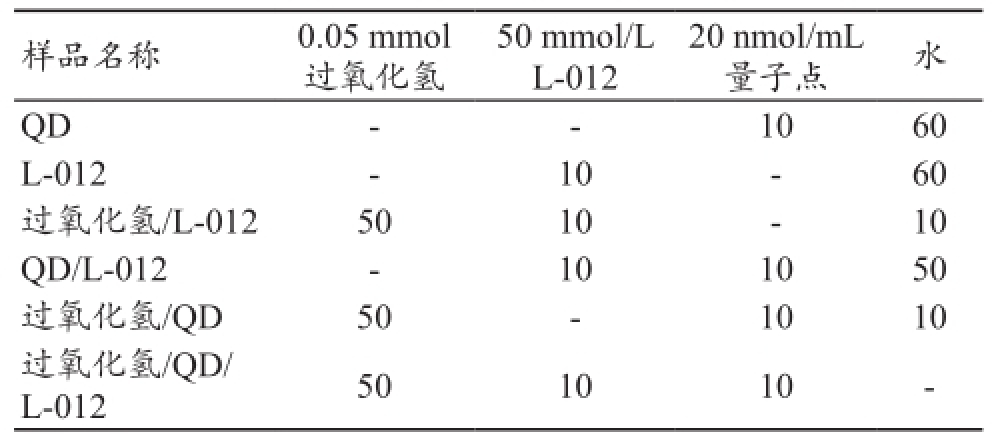
为了研究量子点荧光与化学发光之间可能的干扰影响,先进行了体外成像预实验。利用定量荧光和生物发光成像系统检测过氧化氢、L-012、量子点混合溶液的荧光和化学发光,其结果见图2。该浓度过氧化氢对量子点的荧光强度基本无影响。过氧化氢为阳性对照,能够诱发L-012产生化学发光。而“过氧化氢/QD/L-012”所产生的化学发光与“过氧化氢/L-012”化学发光相近。
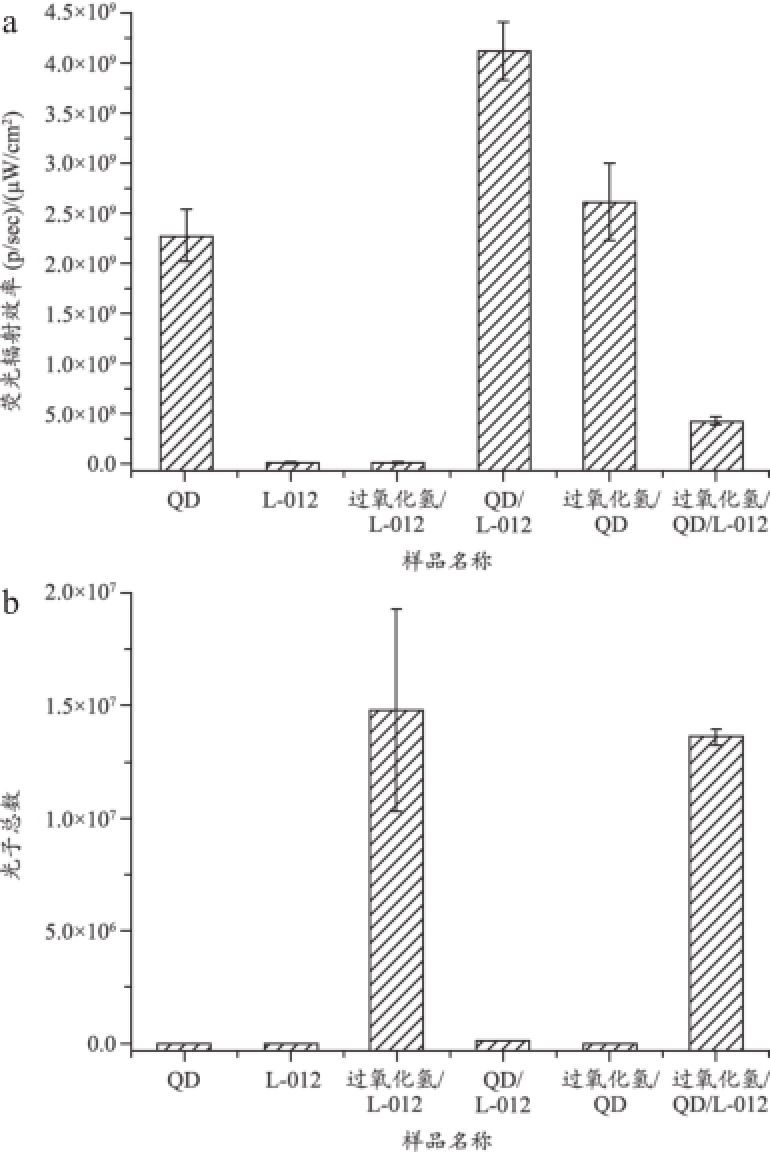
图2 过氧化氢/量子点/L-012的体外成像预实验
注:a.荧光成像;b.化学发光成像。
Zhou等[12]的研究结果表明腹腔注射时间会影响L-012产生的化学发光强度。为了选择最佳的化学发光成像时间,我们在L-012注射后的不同时间点对小鼠进行了化学发光成像,分别为10、20、30、40 min。在20~30 min时,化学发光最强(图3),因此在腹腔注射L-012 20 min后进行小鼠化学发光成像。
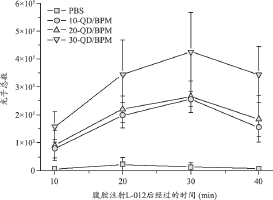
图3 L-012介导的小鼠化学发光强度与注射时间的关系
我们在不同时间点对小鼠同时进行荧光成像和化学发光成像,以此评估双模式成像法研究微球体内降解的可行性,其结果见图4~5。注射后第1 d,荧光强度最强,之后随着天数增加荧光强度减弱,在第28 d时,30 mg量子点复合微球的荧光仍能被检测到。化学发光则在材料植入当天最强,之后随着天数增加,化学发光减弱。第28 d时,量子点复合微球处仍存在微弱的化学发光。
图4 小鼠皮下量子点复合微球的荧光强度随时间的变化
注:a.小鼠皮下不同部位荧光强度随时间的变化;b.小鼠皮下量子点复合微球在不同时间点的荧光成像图。
3 讨论
本文将量子点吸附在可降解微球中得到量子点复合微球,通过荧光显微镜能清楚的观察到量子点复合微球发出的红色荧光。
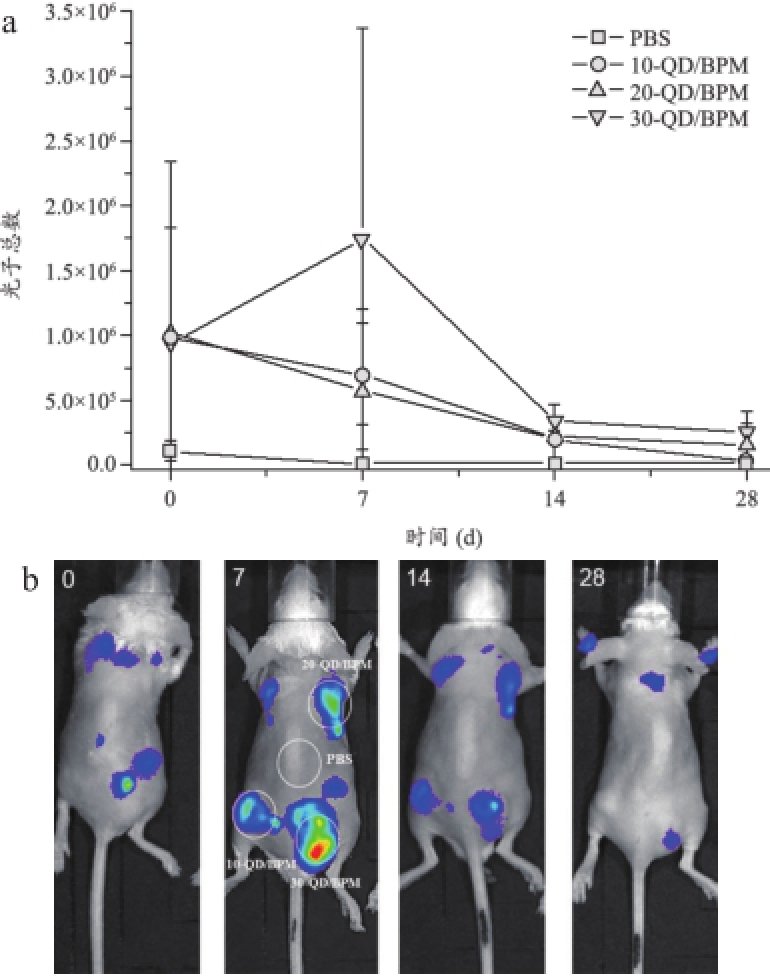
图5 L-012介导的体内化学发光强度随时间的变化
注:a.小鼠皮下不同部位化学发光强度随时间的变化;b.在不同时间点由L-012介导的小鼠化学发光成像图。
化学发光体外实验结果显示,L-012能与过氧化氢溶液反应产生化学发光。加入量子点前后,其光强没有明显的变化。但当过氧化氢溶液浓度增高后,化学发光会显著增强。由于 L-012产生的化学发光波长约为450 nm[14],与量子点激发波波长范围300~500 nm相重合,在空间距离合适的情况下(一般小于100 Å),L-012化学发光产生的能量转移给了量子点,激发了量子点的荧光,产生了化学发光能量的共振转移[15],其原理与荧光能量共振转移(Fluorescence Resonance Energy Transfer,FRET)相似。这一现象可能会对体内化学发光强度及荧光强度产生一定影响。
我们利用定量荧光和生物发光成像系统对植入到小鼠背部皮下的量子点复合微球进行活体荧光成像和化学发光成像。量子点发射波波长为650 nm,植入后1 d荧光达到峰值,之后荧光强度逐渐降低,可能是因为复合微球在小鼠体内随着体液循环逐渐被降解,与此同时,量子点也从微球扩散到体液中。在第28 d时,量子点复合微球的荧光已经非常微弱,而量子点复合微球仍未完全降解。为了使荧光的检测时间与材料降解周期匹配,可以考虑用化学交联法将量子点共价连接在可降解微球上,以提高量子点的稳定性[16]。化学发光强度在注射当天最强,之后随着时间的增加逐渐降低,28 d时,量子点复合微球处仍存在微弱的化学发光。分析其原因可能是由于注射时的创伤促进了活性氧产生,随着皮肤创口愈合,活性氧减少。此外,伴随微球的降解,活性氧的生成也会减少。
4 结论
本研究提供了一种集荧光和化学发光为一体的双模式活体成像方法,用可降解微球负载量子点,通过荧光强度变化跟踪复合微球的降解情况,同时结合L-012化学发光试剂检测活性氧的产生。这个方法用较少的动物即能实现活体检测,对双模式活体成像应用于生物材料研究有参考意义。
[参考文献]
[1] Guo W,Li JJ,Wang YA,et al.Luminescent CdSe/CdS core/shell nanocrystals in dendron boxes:superior chemical,photochemical and thermal stability[J].J Amer Chem Soc,2003,125(13):3901-3909.
[2] Bruchez M,Moronne M,Gin P,et al.Semiconductor nanocrystals as fl uorescent biological labels[J].Science,1998,281(34):2013-2016.
[3] Gao X,Cui Y,Levenson RM,et al.In vivo cancer targeting and imaging with semiconductor quantum dots[J].Nat Biotechnol, 2004,22(8):969-976.
[4] Rosenthal SJ.Bar-coding biomolecules with fluorescent nanocrystals[J].Nat Biotechnol,2001,19(7):621-622.
[5] Wang J,Lu Y,Peng F,et al.Photostable water-dispersible NIR-emitting CdTe/CdS/ZnS core–shell–shell quantum dots for high-resolution tumor targeting[J].Biomaterials,2013,34(37): 9509-9518.
[6] Petryayeva E,Algar WR,Medintz IL.Quantum dots in bioanalysis:a review of applications across various platforms for fluorescence spectroscopy and imaging[J].Appl Spectrosc,2013,67(3):215-252.
[7] Wang C,Gao X,Su X.In vitro and in vivo imaging with quantum dots[J].Anal Bioanal Chem,2010,397(4):1397-1415.
[8] Rosenthal SJ,Chang JC,Kovtun O,et al.Biocompatible quantum dots for biological applications[J].Chem Biol,2011,18(1):10-24.
[9] Chen N,He Y,Su Y,et al.The cytotoxicity of cadmium-based quantum dots[J].Biomaterials,2012,33(5):1238-1244.
[10] Kim J,Kim KS,Jiang G,et al.In vivo real-time bioimaging of hyaluronic acid derivatives using quantum dots[J].Biopolymers, 2008,89(12):1144-1153.
[11] Kim J,Park K,Hahn SK.Effect of hyaluronic acid molecular weight on the morphology of quantum dot-hyaluronic acid conjugates[J].Int J Biol Macromol,2008,42(1):41-45.
[12] Zhou J,Tsai YT,Weng H,et al.Noninvasive assessment of localized inf l ammatory responses[J].Free Radical Bio Med,2012, 52(1):218-226.
[13] Liu WF,Ma M,Bratlie KM,et al.Real-time in vivo detection of biomaterial-induced reactive oxygen species[J].Biomaterials, 2011,32(7):1796-1801.
[14] Zielonka J,Lambeth JD,Kalyanaraman B.On the use of L-012,a luminol-based chemiluminescent probe,for detecting superoxide and identifying inhibitors of NADPH oxidase:A reevaluation[J]. Free Radical Bio Med,2013,65(4):1310-1314.
[15] Huang X,Liang L,Qian H,et al.A Resonance Energy Transfer between Chemiluminescent Donors and Luminescent Quantum-Dots as Acceptors (CRET)[J].Angew Chem Int Edit,2006,45(31): 5140-5143.
[16] Wang L,Qin G,Geng S,et al.Preparation of zein conjugated quantum dots and their in vivo transdermal delivery capacity through nude mouse skin.[J].J Biomed Nanotechnol,2013,9(3): 367-376.
本文编辑 王博洁
Quantum Dots Composite Microspheres for In Vivo Fluorescence and Chemiluminescence Dual-Mode Imaging
YE Yi1, WANG Guo-wu1,WANG Li-ping1, WADA Satoshi2, WANG Jin-ye1
1.School of Biomedical Engineering, Shanghai Jiao Tong University, Shanghai 200240, China; 2.Center for Advanced Photonics, RIKEN, Saitama Wako 351-0198, Japan
Abstract:To develop in vivo fluorescence and chemiluminescence dual mode imaging method for materials, quantum dots (QDs) loaded with biodegradable polymer microspheres (BPM) were subcutaneously injected into the back of mice. L-012 was employed to noninvasively monitor the product of reactive oxygen species. The fl uorescence intensity and chemiluminescence intensity were observed by Quantitative Fluorescent and Bioluminescent Imaging System IVIS Lumina II from Caliper at different time points. The results showed that the fl uorescence of 30 mg BPM/QD could be detected up to 28 d. Meanwhile, chemiluminescence intensity of the implanted microspheres induced by L-012 decreased with time. On day 28, there was still weak chemiluminescence where the microspheres were implanted.
Key words:quantum dots; composite microspheres; in vivo fluorescence imaging; reactive oxygen species; chemiluminescence
[中图分类号]R318.08
[文献标识码]A
doi:10.3969/j.issn.1674-1633.2017.04.008
[文章编号]1674-1633(2017)04-0026-04
收稿日期:2017-02-10
基金项目:国家自然科学基金(30470477,30870635);科技部国家国际科技合作计划项目(2015DFG32730);上海市科学技术委员会国际合作重点项目(15540723900)。
通讯作者:王瑾晔,教授,研究方向为生物材料。
通讯作者邮箱:jinyewang@sjtu.edu.cn