肿瘤特异性成像中固相萃取对Gd-DOTAOCT小分子探针构建的影响
霍天龙,杨硕,孙燕萍,潘峰,胡立宝,康钰,赵赟赟
北京大学人民医院 放射科,北京100044
[摘 要]目的探讨“一步法”构建Gd-DOTA-OCT小分子MR探针,并用固相萃取(Solid Phase Extraction,SPE)对其进行分离。 方法采用商品化DOTA-OCT直接用GdCl 3螯合,并用SPE进行分离和提纯,对分子探针进行紫外分光光度检测、质谱检测和MR信号检测。 结果“一步法”可以成功合成Gd-DOTA-OCT,并用SPE进行成功分离,经质谱检测与理论分子量相同,紫外分光光度法检测探针和MR信号检测证明分子探针完整。 结论Gd-DOTA-OCT小分子探针可以用一步法成功构建,并可用SPE方便地进行分离和纯化,为肿瘤特异性成像奠定基础。
[关键词]分子成像;分子探针;固相萃取;质谱检测;Gd-DOTA-OCT;MR信号检测
分子影像学是多种影像技术交叉和多种学科融合的前沿学科,它针对发生病变的细胞或分子进行成像,目前已迅速成为最具魅力和活力的影像领域,有望在多种疾病的早期诊断,尤其是癌症和神经退行性疾病的早期诊断方面发挥巨大作用 [1]。在多种成像方式中,MR因其兼具有组织分辨力高和相对敏感的特点而成为分子影像研究和突破的热点。
分子成像的关键是分子探针构建。分子探针的构建基础是特异性分子的选择,即针对发生病变的靶组织和靶分子设计特异性探针。围绕特异性分子,在双功能连接剂存在或特异性分子直接与成像核耦合,即可构建特异性分子探针。
构建简单、性质稳定的分子探针是获得最佳成像效果的重要前提,本研究遵循分子探针构建模式,选择奥曲肽(Octreotide,OCT)作为特异性分子,与穴窝状的双功能连接剂 DOTA(四氮杂环十二烷)进行偶联后,用GdCl 3标记,通过SPE分离标记物,可得到MR分子探针,为下一步成像奠定基础。
1 材料与方法
1.1 探针合成
准备商品化的DOTA-OCT(分子量1422,上海默息生物),每次将5 μmol DOTA-OCT溶于10 mL 0.2 mol Tris-HCl(pH 6~7)缓冲液中,将上述液体加热(水浴 60℃)10 min;取分析纯过量GdCl 3(北京国药)10 μmol以上,加入溶液中,室温静置120 min,待螯合完全后进行分离。
1.2 探针分离
采用固相萃取(Solid Phase Extract,SPE)方法进行探针分离。Sep Pak C-18固相萃取小柱(Waters,USA),上样容积6 mL。上样前活化,用5 mL 无水乙醇(北京国药集团,分析纯)、5 mL生理盐水和5 mL空气依次过柱,反应混合物上柱前经过Na 2HPO 4沉淀,超速离心去沉淀后将上清液上柱,用1.5 mL Ep管收集液体,每管1 mL,用负压抽吸泵调(图1)至流速1 mL/s;然后用5 mL生理盐水对小柱进行淋洗,每管收集1 mL;最后用80%无水乙醇(无水乙醇加双蒸水稀释)洗脱小柱,每管1 mL收集洗脱液体,保持流速1 mL/s。各管进行编号以备检测。

图1 固相萃取负压抽吸装置
1.3 绘制分子探针洗脱曲线
使用紫外分光光度法检测各组分。将SPE过柱后各组分分别用紫外分光光度计(TU-1901)检测,用260 nm进行光度扫描,测量3次,取平均值。利用各组分A260 nm数据绘制分子探针洗脱曲线。
1.4 质谱检测
将商品化DOTA-OCT 100 μg(理论分子量 1422),加蒸馏水200 μL溶解,取100 μL进行MAITI-TOF检测。再取100 μL分离后分子探针,进行MAITI-TOF检测。质谱检测由北京大学医学部中心实验室有机质谱室完成。
1.5 MR 信号检测
将SPE后各组分在1.5 mL Ep管内进行MR(MR750w,GE 公司)信号检测,样本固定在Ep管专用塑料管架中,各组分按照收集顺序摆放,图2。采用膝关节线圈扫描,扫描参数:常规T1WI和T2WI扫描,FOV 24 cm,层厚2 mm,间距0.2 mm。

图2 分子探针各组分MR信号检测摆放草图
2 结果
2.1 探针构建
按照标准步骤,用“一步法”可以简便、稳定和可重复性地合成Gd-DOTA-OCT。
2.2 探针紫外检测结果
用260 nm检测分组分紫外分光光度值,结果见图3。
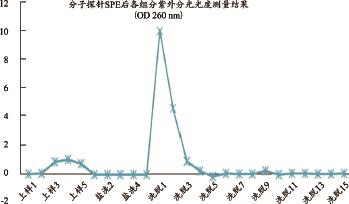
图3 各组分紫外分光光度检测结果条形图
2.3 探针质谱检测结果
商品化的 DOTA-OCT理论分子量为1422,预先检测DOTA-OCT完整性,用MOLTI-TOF实际检测为分子量1421(图4A),证明DOTA-OCT完整。Gd原子量为157,Gd-DOTA-OCT理论分子量为1579,经MOLTI-TOF质谱检测,Gd-DOTA-OCT 实际分子量最高频度值为1576,与理论分子量符合(图4B)。
2.4 MR信号检测
MR扫描显示,各组分各管的MR信号表明,洗脱组分含有较多的Gd组分,见图5。
参照摆放草图,从左到右为分别为上样组分、盐洗组分和洗脱组分,从上到下为样本编分别为1~5,1~10,1~15。从图可以看出,上样组分MR信号较高,提示含有较高浓度的;盐洗组分开始MR信号较高,第10管信号减低很明显,提示Gd成分明显减少;洗脱组分MR信号又开始增高,提示Gd成分再次增多,增高趋势和紫外分光光度结果一致(检测OCT成分),说明洗脱组分既含有较高浓度Gd,又含有较高浓度OCT,因此再次证明洗脱组分含有Gd-DOTA-OCT 分子探针。
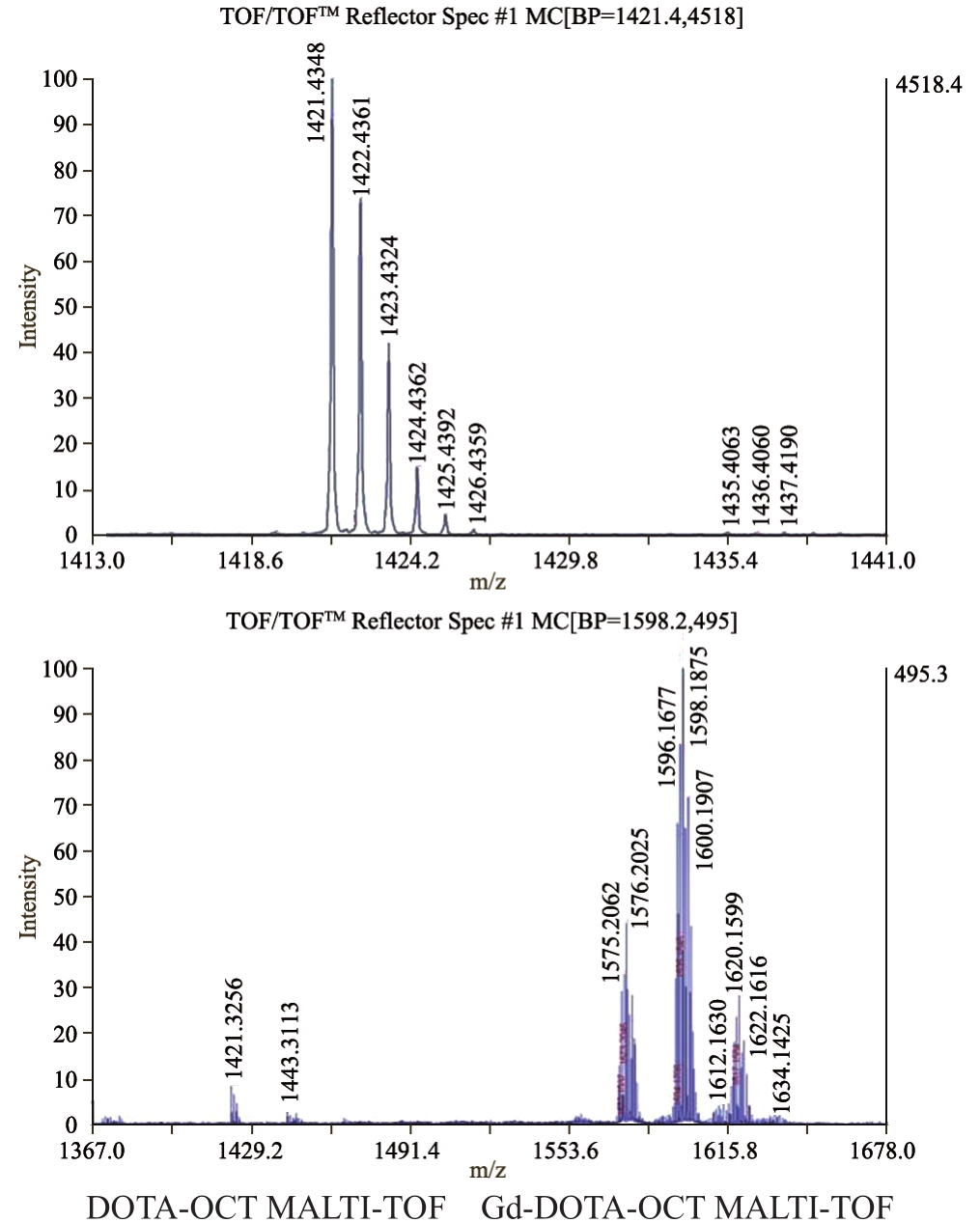
图4 质谱检测图

图5 SPE后各组分MRT1W扫描图像
3 讨论
3.1 Gd-DOTA-OCT分子探针构建策略
分子探针的构建是分子成像的关键和前提条件。根据Gd 3+化学性质,采用化学选择性策略,将双功能螯合剂DOTA的一端和针对SSTR的特异性分子OCT进行偶联,然后用Gd 3+螯合标记,可形成稳定的Gd-DOTA-OCT螯合物,即特异性MR分子探针。理论上,用于成像的Gd具有MR成像能力,而且金属离子不直接与特异性分子相连,不改变其分子结构,不会影响特异性分子与相应受体的结合。
3.2 Gd-DOTA-OCT MR 探针信号检测
对分子探针进行体外 MR 信号测量是验证探针是否有效的必要措施。本研究对纯化的分子探针进行了检测。体外信号的强弱可以推测体内成像效果。小分子容易通过体内转运屏障到达靶组织,因此,在构建分子探针时,小分子要比大分子更优越。Gd类探针分子量较小,有利于体内寻靶。
探针是否能够产生可见的MR信号是实验的关键。MR信号强弱与Gd含量相关。本研究中,上样组分的的MR信号稍高,说明含有Gd 3+成分。游离的Gd 3+不被C-18柱保留,因此上样组分中游离Gd 3+含量的多少直接与反应后未螯合Gd 3+含量的多少相关。本实验反应前GdCl 3过量不多,混合物游离Gd 3+成分较少,因此上样组分MR信号增高不明显。盐洗组分游离Gd 3+含量极微,MR信号不高。从上样到盐洗,各样本信号变化不大。80%乙醇洗脱组分MR信号明显变化,原液的信号极低(尤其是第1和第2洗脱管),而1:50的稀释液信号非常高。根据前期马根维显稀释实验结果,说明Gd成分非常多-与上样组分和盐洗组分不同的是,这些Gd成分不再是游离的Gd 3+,而是螯合态的Gd,即Gd-DTPA-OCT。因此,通过SPE分离后MR信号的检测,证明80%乙醇洗脱组分内含有大量分子探针。
3.3 Gd 3+的安全性和应对策略
与螯合状态的金属离子不同,游离的Gd 3+有毒,如何减低或避免游离Gd 3+产生关系到分子探针在体内是否安全。Gd类对比剂作为非特异性细胞外对比剂,已广泛应用于临床。但近年来发现,某些Gd类对比剂可导致肾源性系统纤维化/肾源性皮肤硬化症(NSF/NSD) [2-3]。通常认为当肾功能不全时,对比剂排泄缓慢,加上酸中毒,离子交换,使Gd 3+大量解离,沉积在组织间隙内,引起组织广泛纤维化。螯合剂,即linker的选择非常重要。螯合剂一方面稳定螯合金属离子,减轻毒性,另一方面避免金属离子直接与特异性多肽相连,以免影响多肽生理活性。现阶段常用的螯合剂中,DOPA是个穴窝状化合物,DOTA 作为一种环形配体较DTPA等线性配体螯合稳定常数更大,它的螯合物最稳定,因而使螯合的Gd不易解离。有关对比剂使用的临床大量统计资料表明,在常用的8种Gd类对比剂中,以DOTA作为螯合剂的对比剂,目前还没有收到NSF相关报告 [4]。因此,DOTA等环状双功能螯合剂是目前构建分子探针的最佳选择。即便如此,在合成分子探针时应采取以下措施增加分子探针安全性:① 在合成螯合物时,Gd 3+是过量的,这样有利于充分螯合,但Gd 3+不能过量太多;② 分离纯化时,一定要充分洗脱游离的Gd 3+。
3.4 特异性分子的选择-生长抑素受体
特异性分子的选择也是研究重点,本研究选用小分子多肽,因为小分子多肽作为特异性分子,没有抗原性,制备相对简单,成本较低,形成的复合物分子较小,目标-本底信号比 值高,代谢快,显像时间相对短,是构建探针的理想选择。生长抑素是一种存在于人脑、下丘脑、胃肠、胰腺等部位内分泌细胞中的活性多肽,具有广泛的生理作用,能抑制生长激素、消化道激素等激素的分泌,抑制胰腺和胃的外分泌,作为 中枢神经内神经递质,还可调节正常细胞和肿瘤细胞的分化增殖,具有抗增殖作用。生长抑素在体内是通过与生长抑素受体(Somatostatin Receptor,SSTR)结合而发挥生理功能的。生长抑素受体有五种亚型(subtype),分别称为SSTR1-5。正常情况下,SSTR表达很少。与正常组织相比,肿瘤组织SSTR表达显著增多。大多数肿瘤如肝细胞癌主要表达SSTR2或SSTR5亚型 [5]。
天然的生长抑素与所有五种亚型都具有很高的亲和力,但在体内受肽酶的作用,半衰期过短(1~3 min) [6],制约了其在临床上的广泛应用。OCT是一种人工合成的、由8个氨基酸组成的活性多肽,是生长抑素的拟似物,它不但保留了天然生长抑 素的药理学活性,而且特异性更高,作用更强。与天然生长抑素不同,人工合成的生长抑素拟似物OCT与不同的亚型有不同的结合活性 [7]。OCT与SSTR2和SSTR5有很高的亲和力,与SSTR3的亲和力较低,并且不与SSTR1和SSTR4结合 [8]。
因此,利用OCT可以设计分子探针对高表达SSTR2的肿瘤进行特异性显像。
3.5 SPE 在分子探针质量控制中的作用
分离纯化是保证实验有效的关键之一。文献中多采用HPLC和SPE进行分离纯化 [9-14]。HPLC可以分离纯化出纯度很高的分子探针,带有紫外检测器,可以检测组分的分离情况。SPE是一种在制药领域广泛应用的样品前处理技术,它的基本原理和HPLC相同,就是利用各组分对固相支持物的结合力大小,对溶解在液相中的物质进行分离。其基本组成和HPLC一样,是用C-18或25填料的柱芯,配以辅助装置,如加压器或负压泵等,即可完成分离工作。多肽因含有疏水侧链,因此在液体流过柱芯时,可以暂时保留在柱子上,而其他无机离子、小分子等不能或几乎很少保留,则被淋洗下来。可以用极性弱一些的溶剂对保留有多肽的小柱进行洗脱,收集洗脱物,就可以得到想要的分子探针。紫外分光光光度法是一种常用的测量溶液中具有特定吸光度物质的方法。测量吸光度之前,可以对溶液进行光谱扫描,根据吸收曲线可以判断吸收峰的数目、位置、相对强度以及吸收峰的。常见的物质是多肽和蛋白等大分子物质,因其内部还有共轭双键,可以吸收一定波长的紫外线 [15-16]。根据朗伯-比尔定律就可以估算出溶液中待测物质的含量。紫外检测方法的优点是操作简便、迅速、不需要复杂和昂贵的设备,不消耗样品,测定后仍能回收使用,低浓度的盐和大多数缓冲溶液不干扰测定。缺点:准确度和灵敏度差一点。干扰物质多,样品中含有其他吸收紫外基团时,结果不太准确。但是可以通过严格的控制减少干扰。多肽和蛋白在260 nm和280 nm也有相应的较强吸收,而且在这一范围内,小分子盐类和有机物,如甲醇、乙醇、乙腈等干扰很小,所以测量结果更准确。一般来说,紫外分光光度法测定蛋白质的浓 度范围为0.1~1.0 mg/mL,在这一浓度范围内,浓度与吸光度具有良好的线性关系,测量结果比较准确。本实验所构建的分子探针的多肽浓度在这一范围内。采用光谱扫描的方法可以 对各组分进行检测,以确定是否含有多肽,就可以明确分子探针在什么组分内。所以,SPE分离纯化加上紫外分光光度检测,是一个进行质量控制简便可行的方法。
4 结论
本文给出了一种简单、有效的MR分子构建方法,并利用SPE法对构建的多肽类小分子探针构建进行质量控制。分子探针质量控制的关键是构建过程简单和方法稳定,分子探针构建的核心是分子探针质量控制,分子探针构建是分子成像的前提。因此,本研究提供的方法可以为构建其他分子探针进行分子成像奠定基础。
[参考文献]
[1] Nolting DD,Nickels ML,Guo N,et al.Molecular imaging probe development: a chemistry perspective[J].Am J Nucl Med Mol Imaging,2012,2(3):273-306.
[2] Grobner T.Gadolinium - a specific trigger for the development of nephrogenic fibrosing dermopathy and nephrogenic systemic fibrosis[J]?Nephrol Dial Transplant,2006,21(4):1104-1108.
[3] Lim YL,Lee HY,Low SC,et al.Possible role of gadolinium in nephrogenic systemic fibrosis: report of two cases and review of the literature[J].Clin Exp Dermatol,2007,32:353-358.
[4] Norenberg JP,Petry NA,Schwarz S.Operation of a radio-pharmacy for a clinical trial[J].Semin Nucl Med,2010,40(5):347-356.
[5] Reubi JC,Waser B,Schaer JC,et al.Somatostatin receptor sst1-sst5 expression in normal and neoplastic human tissues using receptor autoradiography with subtype-selective ligands[J].Eur J Nucl Med Mol Imaging,2001,28(7):836-846.
[6] Harris AG.Somatostatin and somatostatin analogues: phar-macokinetics and pharmacodynamic effects[J].Gut,1994,35(3 Suppl):S1-4.
[7] Reubi JC,Schär JC,Waser B,et al.Affinity profiles for human somatostatin receptor subtypes SST1-SST5 of somatostatin radiotracers selected for scintigraphic and radiotherapeutic use[J].Eur J Nucl Med,2000,27(3):273-282.
[8] Su ZF,Liu G,Gupta S,et al.In vitro and in vivo evaluation ofa Technetium-99m-labeled cyclic RGD peptide as a specific marker of alpha(V)beta(3) integrin for tumor imaging[J]. Bioconjug Chem,2002,13(3):561-570.
[9] Hofland LJ,Lamberts SW.Somatostatin receptors and disease: role of receptor subtypes[J].Baillieres Clin Endocrinol Metab,1996,10(1):163-176.
[10] Lee YS,Jeong JM,Kim HW,et al.An improved method of 18F peptide labeling: hydrazone formation with HYNIC-conjugated c(RGDyK)[J].Nucl Med Biol,2006,33(5):677-683.
[11] Li ZB,Wu Z,Chen K,et al.Click chemistry for (18)F-labeling of RGD peptides and microPET imaging of tumor integrin alphavbeta3 expression[J].Bioconjug Chem,2007,18(6):1987-1994.
[12] Bruus-Jensen K,Poethko T,Schottelius M,et al.Chemoselective hydrazone formation between HYNIC-functionalized peptides and (18)F-fluorinated aldehydes[J].Nucl Med Biol,2006,33(2): 173-183.
[13] Wängler C,Schirrmacher R,Bartenstein P,et al.Click-chemistry reactions in radiopharmaceutical chemistry: fast & easy introduction of radiolabels into biomolecules for in vivo imaging[J]. Curr Med Chem,2010,17(11):1092-1116.
[14] Pretze M,Pietzsch D,Mamat C.Recent trends in bioorthogonal click-radiolabeling reactions using fluorine-18[J].Molecules, 2013,22,18(7):8618-8665.
[15] Kettenbach K,Schieferstein H,Ross TL.18F-labeling using click cycloadditions[J].Biomed Res Int,2014,2014:361329.
[16] Galanaud D,Chinot O,Nicoli F,et al.Use of proton magnetic resonance spectroscopy of the brain to differentiate gliomatosis cerebri from low-grade glioma[J].J Neurosurg,2003,98(2): 269-276.
本文编辑 苏欣  C
C
Efficacy of Brain Tumor Specific Imaging Solid Phase Extraction in the Construction of Gd-DOTA-OCT Small Molecular Imaging Probe
HUO Tian-long, YANG Shuo, SUN Yan-ping, PAN Feng, HU Li-bao, KANG Yu, ZHAO Yun-yun
Department of Radiology, Peking University Poeple’s Hospital, Beijing 100044, China
Abstract:ObjectiveTo discuss the effect of “one step method” on constructing Gd-Tetraazacyclododecane-Octreotide (Gd-DOTA-OCT) small molecular MR imaging probe by adopting Solid Phase Extraction (SPE)method to isolate it from the mixture. MethodsThe commercial DOTA-OCT was chelated with GdCl3 directly, and the mixture was isolated and purified with SPE method, then all the isolated fractions were underwent ultraviolet spectrophotometric detection, mass spectrometric detection and MR signal detection respectively. ResultsGd-DOTA-OCT was synthesized with “one step method” and isolated with SPE method successfully. The actual molecular weight of the probe detected by MALTI-TOF was consistent with the theoretic molecular weight, and the Gd-DOTA-OCT MR probe was intact after being verified by the ultraviolet spectrophotometric detection and MR signal detection. ConclusionGd-DOTA-OCT small molecular MR probe can be successfully constructed with “one step method” and can be isolated and purified with SPE method, which lays a foundation for brain tumor specific imaging.
Key words:molecular imaging; molecular probe; solid phase extraction; mass spectrometric detection; Gd-tetraazacyclododecane-octreotide; MR signal detection
[中图分类号]TP333.3;R445.2
[文献标识码]A
doi:10.3969/j.issn.1674-1633.2017.03.002
[文章编号]1674-1633(2017)03-0006-04
收稿日期:2017-01-13
基金项目:高等学校博士学科点专项科研基金新教师类(2011000 1120083);国家自然科学基金面上项目(81372363)。
通讯作者:霍天龙,副主任医师,主要研究方向为分子影像学。
通讯作者邮箱:huotianlong@bjmu.edu.cn