一种用于碱金属流体热疗性能评价的仿组织透明体模
杨鹏飞 1,王倩 2,陈柏炜 2,盛磊 2,刘静 2,3
1.国家食品药品监督管理总局 医疗器械技术审评中心,北京 100044;2.中国科学院 理化技术研究所,北京100190;3.清华大学 医学院生物医学工程系,北京 100084
[摘 要]碱金属热疗方法具有独特性,其基本原理在于借助目标组织内天然存在的水环境,通过注射微量碱金属如钠、钾或其合金流体来产生强烈的放热化学反应,以达到高效的定向热消融目的。由于碱金属热疗结合了热消融与化学消融这两种消融方法的优势,如何评估其消融效果是一个值得研究的课题。然而,至今为止很难用非标准化的生物组织对其双重消融效果进行测试,利用猪肝等生物组织进行离体实验很难得出其中的化学消融效果。为此,建立一种标准化的仿组织透明体模显得非常重要。本文主要研究了一种用于碱金属流体热疗性能评价的仿组织透明体模,主要采用聚丙烯酰胺为凝胶主要成分、作为温度敏感指示剂的蛋清、作为化学敏感指示剂的酚酞混合而成。初步实验表明这种体模可以较为有效的评估碱金属消融的热疗和化疗效果,为进一步研究碱金属消融放热量、反应生成物的扩散特性以及生物组织内流体输运的过程,明确影响碱金属治疗过程中的消融剂量因素打下基础。
[关键词]仿组织体模;碱金属热疗;聚丙烯酰胺;热化学消融;热疗效果评估;透明体模;钠钾合金
引言
高温热消融正成为肿瘤物理治疗的重要途径。但经典施热方式如射频、微波、激光、超声等在将能量输往深部肿瘤时会存在一定漏热和烫伤问题,尚难做到真正的靶向热疗,且不少设备还因复杂昂贵,一定程度上限制了普及应用。基于对各类热疗方法的全面对比和深入剖析,作者所在的实验室于国际上提出了一种突破传统热疗技术理念的靶向施热方法:碱金属热疗法 [1-3],成功研制出了由钠钾合金组成的室温液态碱金属流体制剂 [3]。特别是,新方法较有价值的一点还在于 [4],碱金属热消融治疗过程完成后的反应产物,如Na +、K +均是生物体内最主要的生理盐水的典型组成元素,无任何毒性,易于为活体组织所吸收,因而这一疗法的实施具有很高的安全性。
由于进入人体的碱金属量很小,其反应产物完全可以被人体组织所吸收,不会对人体造成危害;而OH -会与肿瘤组织中的蛋白质反应而消耗掉 [5]。至于微量碱离子引起的弱碱性环境,实验中还发现其具有独特的抑制肿瘤再生的医学价值,不利于肿瘤细胞复发生长等 [6]。所以,当碱金属完成其热疗作用后,不再对组织造成持续性影响,也因此,有学者直接采用氢氧化钠溶液进行肿瘤治疗,只是其热消融效果偏弱而限制了一定应用 [7-10]。从这种意义上讲,碱金属具有显著的热消融和化学消融双重效果,提升了肿瘤热疗的新优势。利用碱金属热疗法之前,必须对治疗效果进行测试,即其有效性、安全性、可靠性,其中最为关键的测试是对其有效性进行评价,与传统的热疗方法不同,运用碱金属热疗的重大优势在于其结合了热消融与化学消融。然而,至今为止很难用非标准化的生物组织对其双重消融效果进行测试,离体实验很难得出其中的化学消融效果。所以,建立一种标准化的仿组织透明体模就显得非常重要。
1 材料与方法
1.1 透明体模的制备
碱金属热疗方法具有独创性,其基本原理在于借助目标组织内天然存在的水环境,通过注射微量(通常在μL)碱金属如钠、钾或其合金流体来产生强烈的放热化学反应,以达到高效的定向热消融目的。同时,用作穿刺的医用注射微针直径较细(~0.5 mm),因而有效避免了因穿刺而对组织造成的机械创伤。由于不仅需要评估碱金属热疗的热消融效果,还需要评估其化学消融效果,所以体模中必须含有温度敏感指示剂和化学敏感指示剂。
结合之前针对热疗的体模制备方法 [11-12]与高强度聚焦超声(High Intensity Focused Ultrasound,HIFU)体模 [13-14]制备方法,新体模主要采用聚丙烯酰胺为凝胶主要成分、作为温度敏感指示剂的蛋清、作为化学敏感指示剂的酚酞混合而成。使用的材料包括:聚丙烯酰胺、脱气水、从新鲜鸡蛋中获取的蛋清、酚酞、过硫酸铵和四甲基二乙胺 [15]。制备方案如下:取体积比为30%蛋清,42%脱气水、26.2%的40%(w/v)聚丙烯酰胺、1%酚酞(将1 g酚酞添加到100 mL水中,指示范围pH值为8.3~10)充分混合均匀,然后加入0.5%的10%(w/v)过硫酸铵和0.3%的四甲基二乙胺启动聚合,然后将混合溶液转移到一个容器之中,在室温下30 min后溶液自然凝固成仿组织透明体模。由于聚丙烯酰胺单体是一种神经毒素,所以在制备过程中一定要注意安全防护措施 [16-17]。
1.2 碱金属热消融体模实验设计
由于猪肝组织非透明,且其化学消融不可观察,为了进行对比,本文设计了3组实验,每组采用10个样本进行分析。第1组采用猪肝组织进行碱金属消融,第2组采用制作的不含酚酞的体模进行碱金属消融,第3组采用含酚酞的体模进行碱金属消融。向这3组体模中分别注入0.1 mL的碱金属,在注入后约0.5 h稳定后,切开猪肝组织并测量消融大小并记录。由于体模是透明的,可以直接测量第2组体模消融区的大小,通过与猪肝组织的消融区对比,用于评估制作体模热消融的准确性。第3组的测量,由于是化学消融的测量,化学消融较慢,首先将做完实验的组织放置在常温下5 h,然后用pH测试笔测量猪肝消融组织充血带附近的pH值,并以猪肝充血带附近的pH值为准,通过酚酞的颜色判别消融体积,测量含酚酞体模的消融体积,通过对比体模化学消融的体积,用于评估体模评价化学消融的准确性。
2 实验结果与分析
2.1 透明体模的制备
按照上述方法配制好的体模在室温下是一种透明凝胶玻璃态聚合物,颜色为淡黄色,体模弹性好,物理形态类似果冻。刚刚配制的体模效果,见图1。

图1 配制的体模效果图
2.2 碱金属消融猪肝组织
由切开的截面可知若采用猪肝作为实验材料,则只能观察到碱金属消融的热消融效果,并不能观察在碱金属消融过程中化学消融的效果。碱金属热消融猪肝及其切开截面图,见图2。由图2可知,猪肝组织在碱金属消融后的横切面为直径约为1.2 cm的圆形。
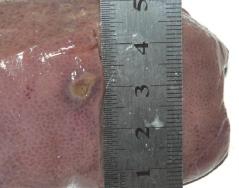
图2 碱金属热疗消融猪肝及其切开截面
2.3 猪肝与不含酚酞体模消融后消融体积统计
采用实验室设计的特别针头的注射器,将碱金属液体缓慢推入到猪肝及体模中,每次注入的碱金属为0.1 mL,利用摄像机纪录碱金属注入体模过程,以观测其化学消融的影响。利用注射器注射碱金属到猪肝组织和体模组织中的实物图,见图3。

图3 注射碱金属到猪肝组织和体模中
在热消融之后,经过处理后体模中剩下的凝固体,体模消融后剩下的凝固组织,见图4。可以通过向烧杯中添加水测量热消融的体积。通过观察其纵切面可知在猪肝中采用碱金属消融获得的凝固体呈椭球形,可以通过测量椭球体的半径,然后通过公式计算消融体积。由于体模中的热量传导较剧烈,获得的凝固体呈不太规则的椭球形,可通过向烧杯中注入水的方法测量获得热消融的体积。

图4 体模消融后热效果
猪肝组织消融体积与不含酚酞体模的消融体积结果,见表1。
表1 猪肝组织消融体积与不含酚酞体模的消融体积
2.4 猪肝与含酚酞体模消融后消融体积统计
为了进一步观察碱金属消融过程中的化学消融效果,采用在体模中加入酸碱指示剂酚酞的方法来进行测量,将1 g酚酞添加到约100 mL体模中,指示范围pH值为8.3~10。按着实验设计的方案,在注入碱金属5 h后,将猪肝组织切开并测量其充血带的pH值,可知其pH值为8.5左右。这时候酚酞应该呈现淡紫色,在加入酚酞体模的烧杯中观察消融的体积,并将这部分消融体积取出来观察,添加酚酞的体模凝固体表观,见图5。
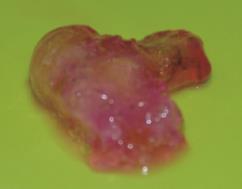
图5 添加酚酞的体模凝固体
碱金属消融后猪肝的横切面实物图,见图6。由图6可知,猪肝组织在碱金属消融后5 h后的横切面为直径约为1.5 cm圆形,且充血带变黑,是热消融后化学消融的进一步体现,通过观察其纵切面可知在猪肝中采用碱金属消融获得的凝固体呈椭球形,只是椭球形的体积比之前单热消融要大一些。
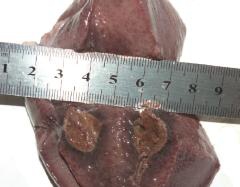
图6 碱金属消融后猪肝的横切面
由于体模中的热量传导较剧烈,获得的凝固体呈不太规则的椭球形,但体积较热消融后偏大,应与OH -的进一步传导有关,可利用之前的方法进一步测量其体积。经过计算及测量获得体积结果,见表2。
表2 猪肝组织消融体积与含酚酞体模的消融体积
3 结论与讨论
仿组织体模在肿瘤热疗的基础研究及临床试验中均具有重要的意义。当前的研究侧重于针对微波热疗或者射频热疗的体模,其重点关注于其导电率和传热效果等特征 [18]。本文结合应用于HIFU的体模,侧重于体模传热性质的研究,并首次在体模制备过程中添加酸碱指示剂,使体模适应于碱金属热疗的需要,在热疗过程中同时获得热消融和化学消融的数据。消融过程中由于热消融蛋清首先变性变得不透明,随着时间的增加,由于OH-的扩散,损伤面不断向外拓展,在20 min左右稳定,表明碱金属消融首先是热损伤,接着是化学损伤,最后趋于稳定。体模对比实验表明,单纯的热损伤获得的消融区体积要小于在生物组织中的体积,误差约-15%,在放置5 h后,结合化学损伤,体模中的消融体积进一步增大,此时比猪肝组织中的消融体积要大,说明在碱金属消融后,化学消融进一步加强的消融效果。
碱金属对肿瘤细胞的破坏主要取决于化学反应放热所产生的热生物学及化学消融作用。作为一种日常生活中需要规避的化学品,碱金属用于治疗时热量的释放及OH-的扩散均需要予以精确控制,以避免对肿瘤周围的正常组织造成损伤。通过建立一种标准化的仿组织透明体模深入剖析碱金属消融放热量、反应生成物的扩散特性以及生物组织内流体输运的过程,可以明确影响碱金属治疗过程中的消融剂量因素,由本文的初步对比实验可知,作为一种具有热疗和化疗相结合的新型疗法,碱金属消融体积的判断不能单纯的用热消融的充血带来判别,由于化学消融因素的存在,实际的消融体积要比热疗过程中的充血带中间的体积要大,本文表明体积误差约为17%。
在体模的配置过程中,由于聚丙烯酰胺单体具有中等的神经毒性,且在配置后的凝胶中也有部分单体残留,因此,需要在配制和使用体模过程中严格执行防护操作规则,避免与眼睛、皮肤和粘膜接触。在实验过程中需要佩戴过滤式防毒面具、化学安全防护眼睛及橡胶手套,实验室保持良好的通风,在实验室工作现场禁止吸烟、进食及饮水等 [19-20]。
[参考文献]
[1] Rao W,Liu J,Zhou YX,et al.Anti-tumor effect of sodium-induced thermochemical ablation therapy[J].Int J Hyperthermia, 2008,24(8):675-681.
[2] Rao W,Liu J.Tumor thermal ablation therapy using alkali metals as powerful self-heating seeds[J].Minim Invasive Ther Allied Technol,2008,17(1):43-49.
[3] Rao W,Liu J.Injectable liquid alkali alloy based tumor thermal ablation therapy[J].Minim Invasive Ther Allied Technol,2009, 18(1):30-35.
[4] Guo Z,Zhang Q,Li X,et al.Thermochemical ablation therapy of VX2 tumor using a permeable oil-packed liquid alkali metal[J]. PLoS One,2015,10(4):e0123196.
[5] Deng Z,Liu J.Chemothermal therapy for localized heating and ablation of tumor[J].J Healthc Eng,2013,4(3):409-426.
[6] Mercade PR,Prieto R,Paterson WR,et al.Diffusion of NaOH into a protein gel[J].Chem Eng Sci,2008,63(10):2763.
[7] de Barra-Cusack F.A user-oriented study of metadata in focal. ie[D].Dublin:Dublin City University,2014.
[8] Choi M,Guntur S,Lee K.An optically transparent tissue mimicking phantom for monitoring the thermal lesion produced by high intensity focused ultrasound[J].J Acoust Soc Am,2012,131(4):3364.
[9] Choi M,Paeng D,Coleman A.A Tissue Mimicking Polyacrylamide Hydrogel Phantom for Visualizing Thermal Lesions Generated by High Intensity Focused Ultrasound[J].Ultrasound Med Biol, 2013,39(3):439-448.
[10] Park S,Guntur S,Lee K.Reusable Ultrasonic Tissue Mimicking Hydrogels Containing Nonionic Surface-Active Agents for Visualizing Thermal Lesions[J].IEEE Trans Biomed Eng,2010, 57(1):194-202.
[11] Liu Y,Zhong P.Development of a cell-embedded tissue-mimicking ultrasound phantom[J].J Acoust Soc Am, 2006,119(5): 3213.
[12] Zhang S,Li C,Wan M.Enhanced Lesion-to-Bubble Ratio on Ultrasonic Nakagami Imaging for Monitoring of High-Intensity Focused Ultrasound[J].J Ultrasound Med,2014,33(6):959-970.
[13] Divkovic G,Liebler M,Braun K.Thermal Properties and Changes of Acoustic Parameters in an Egg White Phantom During Heating and Coagulation by High Intensity Focused Ultrasound[J].Ultrasound Med Biol,2007,33(6):981-986.
[14] Kruse D,Lai C,Stephens D.Spatial and Temporal-Controlled Tissue Heating on a Modified Clinical Ultrasound Scanner for Generating Mild Hyperthermia in Tumors[J].IEEE Trans Biomed Eng,2010,57(1):155-166.
[15] Zuo Z,Liu S.Report on research of calculus fragmentation by HIFU-induced cavitation in Tsinghua University: 1. Effects of tissue-mimicking phantom[C].Bristol:IOP Publishing,2012,15(7):072038.
[16] Culjat M,Goldenberg D,Tewari P.A Review of Tissue Substitutes for Ultrasound Imaging[J].Ultrasound Med Biol,2010,36(6): 861-873.
[17] Urban M,Nenadic I,Qiang B.Characterization of material properties of soft solid thin layers with acoustic radiation force and wave propagation[J].J Acoust Soc Am,2015,138(4):2499-2507.
[18] Wang Q,Xie L,He Z,et al.Biodegradable magnesium nano-particle-enhanced laser hyperthermia therapy[J].Int J Nano-medicine,2012,4715-4725.
[19] Bulin Z,Bing H,Shengli K,et al.A polyacrylamide gel phantom for radiofrequency ablation[J].Int J Hyperthermia,2008,24(7):568-576.
[20] Guntur SR,Choi MJ.An improved tissue-mimicking polyacry- lamide hydrogel phantom for visualizing thermal lesions with high-intensity focused ultrasound[J].Ultrasound Med Biol,
2014,40(11):2680-2691.
本文编辑 袁隽玲  C
C
资 讯
Transparent Tissue-Mimicking Phantom for Evaluating Effect of Alkali Metal Hyperthermia
YANG Peng-fei 1, WANG Qian 2, CHEN Bo-wei 2, SHENG Lei 2, LIU Jing 2,3
1.Center for Medical Device Evaluation, China Food and Drug Administration, Beijing 100044, China; 2.Technical Institute of Physics and Chemistry, Chinese Academy of Science, Beijing 100190, China; 3.Depart ment of Biomedical Engineering, School of Medicine, Tsinghua University, Beijing 100084, China
Abstract:The method of alkali metal hyperthermia is rather unique in tumor ablation. Its basic principle is to produce a strong exothermic chemical reaction through the injection of trace alkali metals such as sodium, potassium or its alloy fluid by using the natural water environment in the target tissues, so as to achieve the goal of efficient directional thermal ablation. For the reason that the alkali metal ablation combines the advantages of thermal ablation and chemical ablation together, therefore, how to evaluate its ablation effect is a subject worth to be studied. So far, it is difficult to evaluate such double effects of ablation with non-standard biological tissues, for example, the use of liver tissue in vitro is very rare among the chemical ablation effect. Therefore, it is very important to establish a standardized and transparent phantom. This article mainly studied a kind of tissue transparent phantom for evaluating the properties of alkali metal hyperthermia. Such phantom was mainly mixed by polyacrylamide gel composition, egg white as a temperature sensitive indicator and phenolphthalein as the chemical sensitive indicator. The preliminary experimental results showed that this model can be used to evaluate the hyperthermia and chemotherapy effects of alkali metal ablation, and laid a foundation for further studying the heat release amount, diffusion properties of reaction product, the process of the fluid transport in biological tissues, as well as the ablation dose factors that affect the alkali metal treatment process.
Key words:tissue-mimicking phantom; alkali metal ablation; polyacrylamide; thermal-chemical ablation; hyperthermia effect evaluation; transparent phantom; sodium potassium alloy
[中图分类号]R314;R730.59
[文献标识码]A
doi:10.3969/j.issn.1674-1633.2017.03.004
[文章编号]1674-1633(2017)03-0014-04
收稿日期:2015-12-10
基金项目:国家自然科学基金(NSFC 5137610);创新品种临床前研究(Z141100000514005);中国博士后科学基金项目(2014M550747)。
作者邮箱:shenglei@tsinghua.edu.cn