基于深度学习的CT脑影像分类方法用于阿尔茨海默病的初步筛查
惠瑞1,2,高小红3,田增民1
1.中国人民解放军海军总医院 神经外科,北京 100048;2.布莱根妇女医院 神经外科,波士顿 02115;3.密德萨斯大学 计算机科学部,伦敦 NW4 4BT,英国
[摘 要]目的本研究旨在探讨卷积神经网络(Convolutional Neural Network,CNN)深度学习在脑CT影像分类中的应用,达到提高影像分类智能化程度的目的,为临床筛查阿尔茨海默病(Alzheimer Disease,AD)提供便利。方法收集2014~2016年3个类别的脑CT影像资料,其中包含AD、器质性病变(如肿瘤、脑出血等)和正常老年化的受试者的数据。由于本组CT脑图像高度方向(z轴,层厚5 mm)单位长度相对水平方向大的特点,本研究将CT二维轴位CNN图像和三维分割组块进行融合运算分类后对照已有的诊断。结果AD、器质性病变和正常老年化的分类准确率分别为84.2%、73.9%和88.9%,平均为82.3%。结论本研究为初筛AD提供了新的方法。
[关键词]卷积神经网络;图像分类;CT影像;阿尔茨海默病
引言
阿尔茨海默氏症(Alzheimer’s Disease,AD)在全世界65岁以上老年人的发病率约为4%~6%,最近统计数据表明全球已有将近4000万名AD患者[1]。事实上,估计有60%的老年人有类似AD的表现但无法得到确诊[2]。此外,患者到达AD中晚期后治疗手段非常有限,因此AD的早期诊断显得尤为重要。
计算机断层扫描(CT)因其快速、简单、廉价,同时又具备较好的成像质量的特点,几乎在每一家医院使用。此外,CT还可能是第一个被引入到人类大脑研究的成像工具[3]。然而,虽然大多数可疑的脑病患者虽都需要进行CT检查,但就功能性脑病患者而言,其主要目的为排除其他可能的器质性疾病(例如,颅内肿瘤、脑出血、脑梗死等)。因为CT影像对软组织的对比度较差,且检查人员在手工测量脑结构(例如内侧颞叶、海马结构等)时会出现一些误差,所以对于AD等功能性疾病,CT并没有作为主要诊断工具[4]。
另外,在CT脑影像对AD的辅助诊断方面,特定的脑萎缩不仅与AD有关,也与正常老化和脑血管疾病有关。比如,内侧颞叶萎缩已被证明是AD最重要的诊断标志物,但这不具备很强的特异性。此外,AD患者中也发现了海马(尤其是左侧海马)的萎缩,这也会出现在健康的老年人身上[5]。然而,通过精确测量CT影像中颞角和鞍上池萎缩比率可以提高90.2%的诊断准确性[5]。因此,基于CT影像的线性测量在AD患者诊断过程工作是很有价值的。
目前已有利用核磁共振影像(MRI)训练神经网络模型以早期诊断AD的文献报道,例如利用基于改进的AlexNet神经网络模型进行MRI数据训练,已取得了较好的测试结果[6]。但在实际临床工作中CT较MRI更易获得,所以本研究以CT影像为主要研究对象。为了降低在人工测量过程中可能出现的较大误差[4],本研究是利用卷积神经网络(Convolutional Neural Network,CNN)的最新技术,对阿尔茨海默病的CT影像数据的分类、分割和测量进行非监督的自动处理。在本研究中,对AD患者CT影像的分类,即对健康(正常)老年化和脑内病变CT影像的识别是本研究的重点。
深层学习模型是一类机器学习层次结构,通过从低层级构建高级特性[8-9],从而进行自动化特征构建。这些结构模型中应用较广的是卷积神经网络[9]。CNN由一组机器学习算法构成,包括涉及学习的算子处理层(线性和非线性)等多个层级(深层),因此必须通过从低层级数据构建高层级的数据,从而实现信息或特征的自动化构建[10]。已经证明,在适当的规则下训练,神经网络在不依赖手工采集特征的条件下可以很好的实现对物体的识别,如尺度不变特征变换、加速稳健特征[11-12]。此外,神经网络已被证明对存在一定变量的输入数据相对不敏感[10]。
受生物视觉信号处理机制的启发,CNN运用前馈人工神经网络来模拟变化的多层感知器[13]。利用此特性,它被广泛地用于图像和视频的识别。目前,CNN已经被证明是理解图像内容的有效模型,在图像识别、图形分割、图像检测与提取等方面可以得到很好的结果[14]。Liu等[15]利用了5个卷积层的CNN结构设计,采用最大池化的方法进行了3次降采样取得预训练网络来计算MRI图像在各层的特征,从而对AD等不同疾病进行分类。此外,计算机硬件技术的进步已经使CNN在图像处理方面的应用成为现实。
然而,CNN在计算机视觉信息处理领域的成功应用主要基于二维图像的处理。虽有少数研究报道CNN可以在处理二维视频中发挥作用[13],但在一定程度上对三维图像进行处理却与此不同。在本研究中,我们使用二维和三维模式的CNN来处理CT脑影像。
1 材料和方法
1.1 数据预处理和三维CT影像平均化
本研究共收集了342位受试者的CT数据,其中71人为AD患者,138人患有各种类型的器质性病变,133人为老年正常受试者。在我们的资料中,每位受试者CT数据的层数和像素有所不同,层数为26到35层,像素为512×512 或 912×912(图 1)。
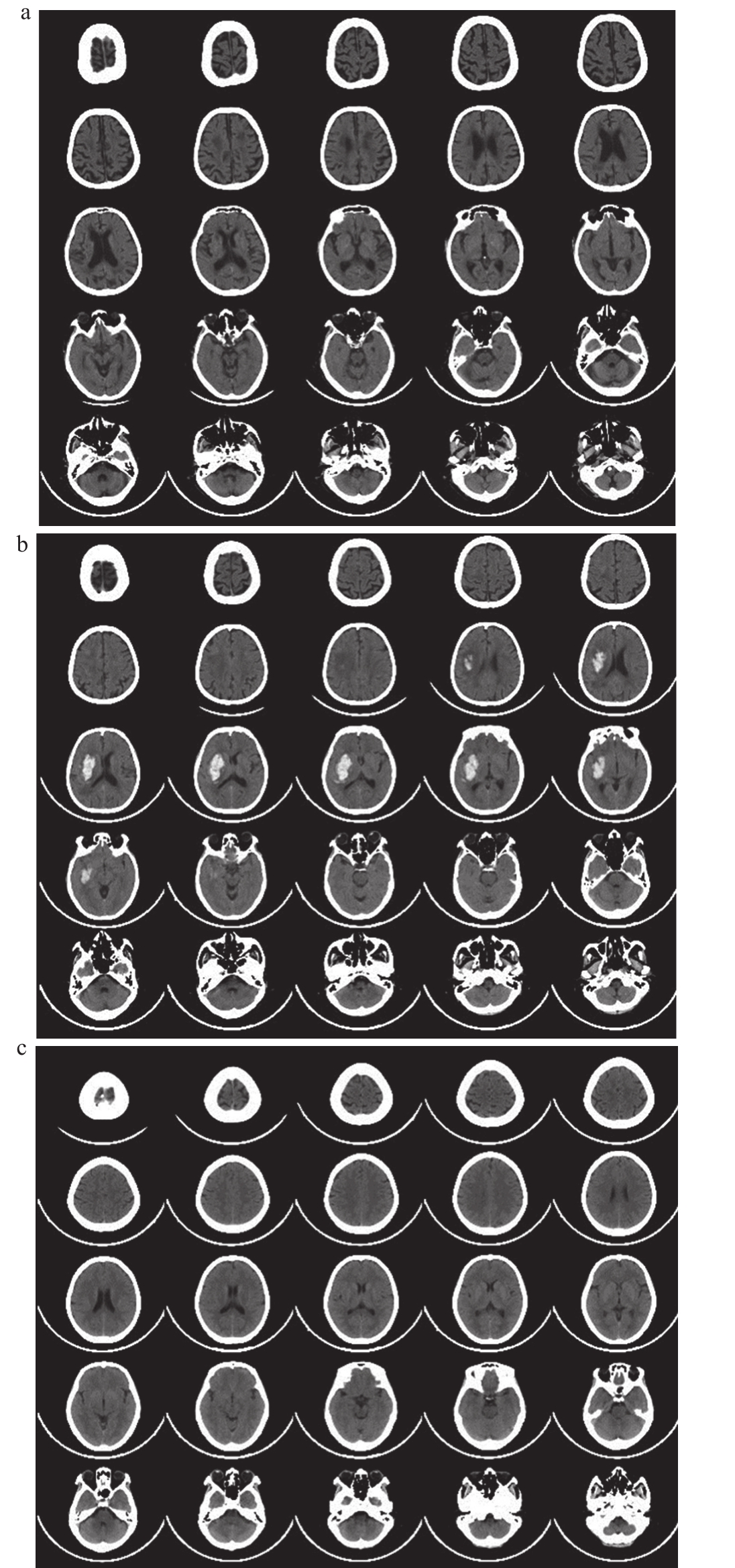
图1 本研究受试者的CT影像
注:a. AD患者;b.器质性病变患者;c.正常对照者。
对于二维影像,每个层面都进行图像分割并标准化为360×360像素。对于正常人和AD患者的CT影像数据,取中间的20个层面作为此类影像的研究数据库。而对于有器质性病变的CT影像数据,只选取包含可见病变(例如肿瘤)的层面作为研究数据库。结果显示,虽然而对于有器质性病变的CT影像研究数据库是3类中最大的,但其层面的总数与其他数据相近。
同时,对于三维影像,每个受试者的CT影像数据分别进行注册、图像分割并标准化为200×200×20像素的三维图像。这样,CT数据相对层厚为5 mm。由于CT可很好地显示脑周围的骨性结构,我们选择刚体几何变换如公式(1)所示。
其中,T为需要确定的包含平移、旋转和缩放参数的变换矩阵,Imoving为要注册的源图像,Ifixed为图像模板。因此,为了实现T中各参数的确定,公式(2)需被最小化。
其中,xi指从图像模板(作为参考)和源图像(作为源)图像中选择的若干对应点。为了补偿每个图像可能因强度不同而出现的缩放,增加了一个额外的强度缩放因子sa。
为了实现公式(2),我们选择一个有30个层面的CT数据模版作为图像模版,其他CT图像数据则与之对齐。
完成标准化后,每个三维CT图像数据被分解为40×40×10像素的组块。与处理二维CT图像类似,对于AD患者和正常人的数据,所有组块都被用于数据训练,而对于有器质性病变CT图像数据,只使用含有可见病变的组块。
1.2 二维与三维CNN的实现
在本研究中,二维CNN是沿大脑轴位方向使用基于MatConvNet[16-17]的Matlab软件实现的。图2显示二维和三维CNN的融合过程。具体来说,针于训练图像数据[(x(i),y(i))],图像x(i)为三维图像,y(i)为图像x(i)的指示符向量,图像的特征参数,即w1……wL,将通过处理基于CNN的公式(3)来完成数据训练。

图2 二维和三维CNN的融合过程
其中,?为适当的损失函数(如hinge损失函数或log损失函数)。
为获得这些特征参数,二维CNN使用二维卷积算法在同层面的卷积层提取上一层面的特征参数,然后应用叠加性偏差,结果通过S函数传递,如公式(4)中所示。
在公式(4)中,tanh(.)表示双曲正切函数;m为上一层(i-1)th的数据参数指数;bij指特征参数的偏差;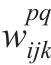 是指在位置(p,q)的内核连接到的第k个特征参数;pi,Qi是指内核的高和宽。
是指在位置(p,q)的内核连接到的第k个特征参数;pi,Qi是指内核的高和宽。
在二次采样层,通过池化上一层面提取的特征参数使该层特征参数的分辨率降低,从而增加不变扭曲的输入。CNN的架构可以通过交替的方式堆叠多层卷积和二次采样来实现。在CNN的参数中,如偏差参数bij和权重参数![]() 通常使用监督或无监督的训练方法[8,17-18]。
通常使用监督或无监督的训练方法[8,17-18]。
另外,为了保留CT影像Z轴方向的信息,人们对三维CNN进行了探索。在三维CNN中,通过三维内核向x-y轴方向(即二维)及z轴方向的卷积来实现,在这里公式(4)可以扩展为公式(5)用来计算在ith层面上jth特征参数中某点位置的值。
其中Ri为三维内核在z轴方向的数值,![]() 为内核(p,q,r)th连接到上一层的特征参数mth的数值。此外,三维池化也被引入以增加输入图像中失真和噪声中的不变参数[19]。
为内核(p,q,r)th连接到上一层的特征参数mth的数值。此外,三维池化也被引入以增加输入图像中失真和噪声中的不变参数[19]。
1.3 融合运算结果
在二维CNN模型中,每个层面的二维图像应用于训练模型,而三维CNN模型则使用立方体组块(40×40×10)。因此,分类是在整体数据的级别上进行的,且均结合了这两个模型。对于正常老年化组,使用二维和三维数据分别对模型进行训练后,其95%以上的二维层面数据和全部的三维组块被标记为“正常老年化”。因AD或病变通常表现于一个以上的层面,虽然有5%的二维数据(即一个层面)没有被标记,但并不影响最终结果。而对于AD组和器质性病变组,因某CT影像可能同时具有AD组和器质性病变组的特征,经二维和三维模型训练后,在用于测试的CT数据时,如果标记为AD的层面或组块多,则分类为AD组,反之则分类为器质性病变组。
2 结果
表1为图像处理过程中的数据信息。一个受试者的CT影像通常包含26到35个层面,共有342个三维影像数据,5876个二维层面。这些数据被分为3组,应用CNN完成训练、验证(避免过度拟合)和数据测试。
表1 每个运算过程中使用影像数据的数量(n)
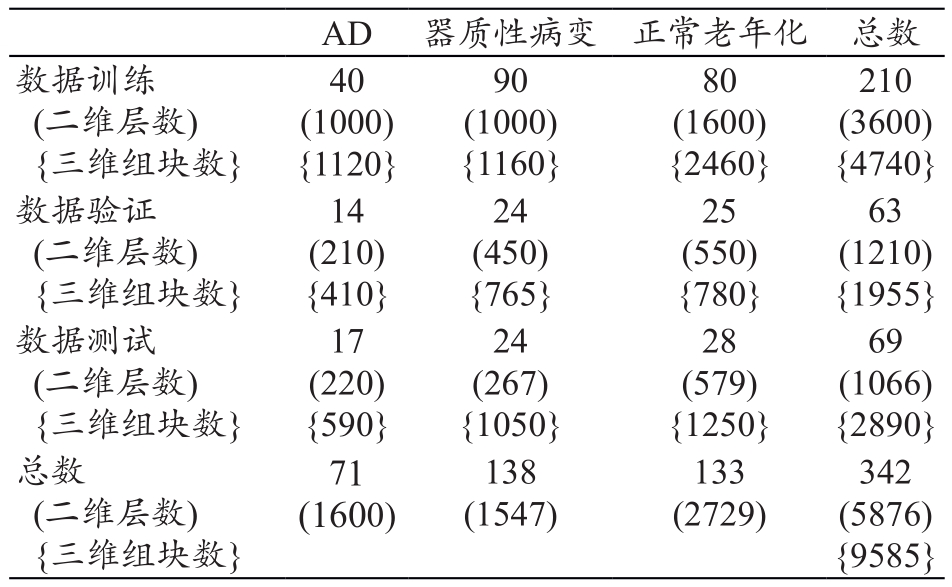
注:括号内的数字是该类中二维影像层数和三维组块数。
总共有180组数据被随机抽选用来测试CNN分类系统,其中包含2700个二维图像和3795个三维组块。每个组之间的数据的划分是随机选择的,测试的混淆矩阵,见表2。CNN分类完成后,对照受试者的诊断计算分类准确率。
表2 3个类别测试结果的混淆矩阵及准确率(例)
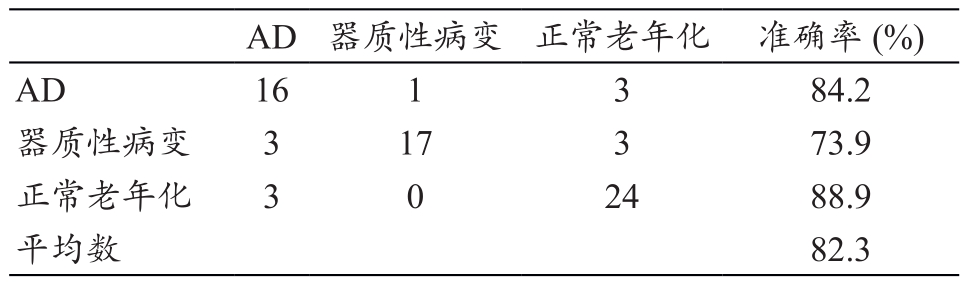
最终,经过CNN分类运算及与原诊断对照,3类CT影像AD组、脑器质性病变组和正常老年化组的分类准确率分别为84.2%、73.9%和88.9%,平均为82.3%。
3 讨论与结论
本研究应用了目前流行的CNN深度学习的方法为一组脑CT影像分类,该组CT影像的受试者已明确诊断为AD、脑器质性病变和正常老年化,CNN完成了自动分类运算并具有很高的准确性。
在本组数据中,虽然属于脑器质性病变的类别中包含最多的影像数据(n=138),但并非每个二维层面或三维组块都包含病变信息。因此,脑器质性病变组图像数目实际最少,只有1717个层面,AD组和正常老年化组分别为1430和2729个层面。虽然3个类別的数据总量差异不显著,特别是AD和脑器质性病变组数据量十分接近,分类准确率的结果似乎与每组数据的数量有相关性。例如,正常老年化组的数据量最大,总共有2729个层面,其分类准确率88.9%也在3类中是最高的。所以,可以得到的结论是,更多的数据将获得更好的分类结果。
此外,虽然CT影像实际为三维影像,但因其层厚较大(5 mm)导致三维CT影像的分类不如二维影像分类精确。因此,本研究融合使用二维和三维CT影像数据,以获得更好的结果。结果显示,对AD患者的CT影像分类准确率达到84.2%,其高准确性使该方法可以作为AD的初筛工具使用,为早期诊断AD提供重要保证。
[参考文献]
[1] Querfurth HW,Laferla FM.Alzheimer’s disease[J].New Engl J Med,2010,362(4):329.
[2] Dementia: https://www.gov.uk/government/news/[EB/OL].[2015-03].
[3] Waldemar G,Høgh P,Paulson OB.Functional brain imaging with single-photon emission computed tomography in the diagnosis of Alzheimer’s disease[J].Int Psychogeriatrics,1997,91(1):223.2.
[4] Jobst KA,Smith AD,Szatmari M,et al.Detection in life of confirmed Alzheimer’s disease using a simple measurement of medial temporal lobe atrophy by computed tomography[J].Lancet,1992,340(8829):1179-1183.3.
[5] Zhang Y,Londos E,Minthon L,et al.Usefulness of computed tomography linear measurements in diagnosing Alzheimer’s disease[J].Acta Radiologica,2008,49(1):91-97.
[6] 吕鸿蒙,赵地,吃学斌.基于增强AlexNet的深度学习的阿尔茨海默病的早期诊断[J].计算机科学,44(6):50-60.
[7] Oksengaard AR,Haakonsen M,Dullerud R,et al.Accuracy of CT scan measurements of the medial temporal lobe in routine dementia diagnostics[J].Int J Geriatr Psych,2003,18(4):308-12.
[8] Fukushima, K.Neocognitron:A self-organizing neural network model for a mechanism of pattern recognition unaffected by shift in position[J].Biol Cyb,1980,36:193-202.
[9] Lécun Y,Bottou L,Bengio Y,et al.Gradient-based learning applied to document recognition[J].P IEEE,1998,86(11):2278-2324.
[10] Lecun Y,Huang FJ,Bottou L.Learning methods for generic object recognition with invariance to pose and lighting[A].Computer Vision and Pattern Recognition[C].Washington:Proceedings of the 2004 IEEE Computer Society Conference on IEEE,2004,2:97-104.
[11] Kumar P,Henikoff S,Ng PC.Predicting the effects of coding non-synonymous variants on protein function using the SIFT algorithm[J].Nat Protoc,2009,4(7):1073-1081.
[12] Feng Q,Xu W,Zhang X,et al.Research of image matching based on improved SURF algorithm[J].Telk Indon J Elec Engin,2013,12(2):1395-1402.
[13] Lecun Y.LeNet-5, convolutional neural networks[J].
[14] 张柏雯,林岚,吴水才.深度学习在轻度认知障碍转化与分类中的应用分析[J].医疗卫生装备,2017,38(9):105-111.
[15] Liu F,Shen C.Learning deep convolutional features for MRI based Alzheimer’s disease classification[EB/OL].https://www.researchgate.net/publication/261636125_Learning_Deep_Convolutional_Features_for_MRI_Based_Alzh- eimer’s_Disease_Classification.
[16] Xu W,Xu W,Yang M,et al.3D Convolutional Neural Networks for Human Action Recognition[J].IEEE T Pattern Anal,2012,35(1):221-231.
[17] Vedaldi A,Lenc K.MatConvNet: Convolutional neural networks for MATLAB[J].2014:689-692.
[18] Marc,Huang FJ,Boureau Y,et al.Unsupervised learning of invariant feature hierarchies with applications to object recognition[A].Columbus:Computer Vision and Pattern Recognition[C],2007:1-8.
[19] Lazar NA,Luna B,Sweeney JA,et al.Combining brains: a survey of methods for statistical pooling of information[J].Neuroimage,2002,16(2):538-550.
CT Brain Image Classification Based on Deep Learning in Application of Screening of Alzheimer Disease
HUI Rui1,2, GAO Xiaohong3, TIAN Zengmin1
1.Department of Neurosurgery, Navy General Hospital of the Chinese People’s Liberation Army, Beijing 100048, China;2.Neurosurgery Department, Brigham and Women’s Hospital, Boston 02115, US;3.Department of Computer Science, Middlesex University, London, NW4 4BT, UK
Abstract:ObjectiveThe study aims to discuss the application of deep leaning based on the convolutional neural network (CNN) in the CT imaging classification, so as to improve the intelligent image classification for clinical screening of Alzheimer disease (AD).MethodsThree categories of brain CT image data, including the data from AD patients, organic lesion patients (eg. tumor, cerebral hemorrhage) and normal aging patients were collected. For the reason that the relative horizontal direction in CT brain image was high (z axis, seam thickness 5 mm), we fused the two dimensional and three dimensional CNN data in this study, and the results were compared with the diagnostic results. Results The accuracy rates of diagnosis for AD patients, organic lesion patients and normal aging patients were 84.2%, 73.9% and 88.9% respectively, with mean rate of 82.3%. Conclusion Our results supply a new method for preliminary screen of AD.
Key words:convolutional neural network; image classification; CT image; Alzheimer disease
[中图分类号]R814.42
[文献标识码]A
doi:10.3969/j.issn.1674-1633.2017.12.004
[文章编号]1674-1633(2017)012-0015-05
收稿日期:2017-11-08
修回日期:2017-11-26
基金项目:国家863计划(2007AA420100-1);European Union’s Framework 7 research program under grant agreement (PIRSESGA-2010-269124)。
作者邮箱:huirui2002@163.com
本文编辑 王静