功能神经导航及术中磁共振对语言区病变语言保护作用研究
李昉晔,陈晓雷,侯远征,孙国臣,张家墅,余新光,许百男
解放军总医院 神经外科,北京 100853
[摘 要]目的探讨功能神经导航及术中磁共振在邻近弓形束病变手术中提高切除程度、全切率和保护患者语言功能的作用。方法收集65例病变累及优势半球皮层下语言传导束即弓形束的患者。评价功能神经导航和术中磁共振对手术策略、病变切除程度、全切率及语言功能的影响。结果65例患者在功能神经导航和术中磁共振引导下行病变切除术,与第一次iMRI结果比较,术者对12例患者切除程度判断不准确,误判率为18.5%。非胶质瘤病变首次iMRI确认全切除。54例胶质瘤中,第一次iMRI证实,21例全切除,33例有肿瘤残留。25例根据术中影像更新手术计划后切除残余肿瘤的平均切除程度从87.3%提高到97.4%,所有胶质瘤患者的平均切除程度从92.1%提高到96.8%。术后2周有15例(23.1%)原有症状加重或新发失语。6个月随访时,2例患者(3.2%)存在长期语言功能障碍。结论功能神经导航和术中磁共振有助于在最大化切除病变的同时,最小程度损伤患者的语言功能,提高患者术后健康相关生活质量。
[关键词]神经导航;术中磁共振;语言;弥散张量成像;弓形束
引言
胶质瘤是颅内最常见的神经上皮肿瘤,文献对于胶质瘤的治疗存在很多争议,因为胶质瘤很难做到细胞学水平的完全切除,外科医生最多能做到的是影像学切除[1]。目前临床上胶质瘤的主要治疗方法是手术切除的基础上,辅以放疗和化疗。语言区病变,尤其是胶质瘤,语言皮层和皮层下传导束边界不清,术后患者语言功能障碍极易加重。在本研究中,我们量化分析手术前后的病变体积变化,评价多模态功能神经导航和术中磁共振对病变切除程度、全切率和语言功能的影响。
1 资料与方法
1.1 研究对象
收集2012年1月~12月65例病变累及优势半球语言传导束弓形束的患者。入组标准:① 爱丁堡利手调查表证实患者为右利手,功能磁共振检查证实患者左侧半球为优势半球;② 病变邻近优势半球皮层下语言传导束;③ 患者能够独立完成语言功能相关评估。排除标准:① 颅内多发病变;② 爱丁堡利手调查表证实患者为左利手,功能磁共振表明右侧半球为优势半球;③ 病变位于非优势半球;④复发胶质瘤;⑤ 患者本人无法完成语言功能相关检查。65例入组患者在功能神经导航和术中高场强磁共振引导下手术。这些患者术后病理证实胶质瘤54例,非胶质瘤11例(转移癌5例,海绵状血管瘤6例)。男性患者47例,女性患者18例,平均年龄(42.8±11.1)岁,范围20~75岁。
1.2 术前磁共振检查
所有磁共振检查扫描均应用1.5 T高场强术中磁共振(Espree,Siemens,Germany),手术前后及随访时检查序列参数相同。
磁共振检查序列参数[2]:T1WI:T1加权三维磁化强度预备梯度回波序列参数:TE 3.02 ms,TR 1650 ms,矩阵256×256,视场 250 mm×250 mm,层厚1 mm。T2WI:TE 93 ms,TR 5500 ms,矩阵 512×512,视场30 mm×230 mm, 层 厚 3 mm。T2flair:TE 84 ms,TR 9000 ms,矩阵256×256,视场230 mm×230 mm,层厚3 mm。
DTI:单次投照弥散加权自旋回波序列(SSEPI)。参数 :TE 147ms,TR 9400 ms,矩阵 128×128,视场 251 mm×251 mm,层厚3 mm,带宽1502 Hz/Px。弥散权重(高b值)1000 s/mm2,12个方向,同时进行一次0弥散加权(低b值:0 s/mm2)成像用于后期处理时消减成像区域外周噪声。体素(VOXEL)大小为1.9 mm×1.9 mm×3 mm,无间隔采集40层,共采集5次以提高信噪比。
BOLD-fMRI:梯度平面回波成像序列(GRE-EPI)。参数:TE 60 ms,TR 2540 ms,视场192 mm×192 mm,层厚3 mm。组块设计完成动词联想或图片命名任务,激活(Activation)和静息(Baseline)两种状态相互交替3次。
增强T1WI和3D MPRAGE参数相同,增强剂为钆喷酸葡胺(Bayer,Germany)。所有患者的磁共振数据传输至导航计划工作站(Brainlab,Germany)。
1.3 制定术前手术计划
患者术前磁共振的原始Dicom数据传输到导航计划工作站后,我们用iPlan 3.0软件(Brainlab,Germany)首先对解剖、功能和代谢等影像资料进行图像融合、配准。确认无误后,然后用“Object Creation”模块标记病变范围,对于磁共振影像增强明显的如高级别胶质瘤和转移瘤,根据增强T1WI来描记肿瘤,无强化的低级别胶质瘤,根据T2WI或者T2 fl air磁共振上高信号范围描记肿瘤。以混杂信号范围描记海绵状血管瘤,如果周围有含铁血黄素沉积,根据T2WI上含铁血黄素环描记。每个层面描记病变后,轮廓连接在一起就形成了病变的3D结构。工作站可自动计算重建的三维模型的体积,我们可以根据这个模块比较手术前、中、后病变体积的大小变化。
“BOLD Mapping”模块中,我们将阈值设置为3.5,P<0.001的左额下回皮层激活区域标记为Broca区,左颞上回后部皮层激活区域为Wernicke区。用“Fiber Tracking”重建左侧弓状束。基于张量偏离算法的线性扩展法,重建的弓形束的方向为相邻体素的最大矢量轴方向。FA阈值为0.15,长度阈值为50 mm。应用多ROI的方法在融合后的T1WI解剖像上重建弓形束:第一个ROI是在左侧额下回皮层下白质,第二个ROI在放射冠的外侧,第三个ROI在左侧颞上回后部皮层下白质,同时通过这三个ROI的皮层下纤维束即为弓形束。
完成术前手术计划后,将计划数据传输到导航工作站(Vector Vision Sky navigation system,Brainlab,Germany)中。导航注册成功后,直接连接手术显微镜(OPMI Pentero,Carl Zeiss,Germany)后,就可以实现显微镜下导航手术。
1.4 术中磁共振检查
主刀医生掌握术中磁共振扫描时机,当主刀医生认为肿瘤切除完全,按照镜下导航提示手术已接近功能区,或者脑脊液流失明显导致术中脑移位影响手术准确性时,行术中磁共振检查。术中磁共振扫描结束后,主刀医生根据有无肿瘤残留,或者残留肿瘤与周围功能区的三维关系决定是否进一步手术。如果需要继续手术,根据术中影像资料更新导航,直至肿瘤切除满意。
1.5 评估病变切除程度和全切率
当术者认为需要进行磁共振扫描时,先填写调查问卷,术者估计肿瘤的切除程度,然后与术中磁共振影像结果进行对比,计算术者的误判率。根据术中磁共振扫描残留肿瘤,自动计算肿瘤体积,肿瘤的切除程度(EOR)=(术前肿瘤体积-残留肿瘤体积)/术前肿瘤体积。切除程度定义:全切除指肿瘤切除程度≥98%,次全切除指肿瘤切除程度≥90%,大部分切除指切除程度<90%。
1.6 围手术期及随访时语言功能评估
入治疗组的患者于术前、术后以及3~6个月随访时接受语言相关检查,检查内容是西方失语症成套试验(WAB)检查,我们用失语指数(Aphasia Index, AQ)用来评价手术前后、随访时的语言功能,总分为100分,AQ<93.8分判断为失语。
1.7 统计学分析
采用SPSS 19.0(IBM,USA)进行数据处理,计量资料以x-±s表示。Wilcoxon检验比较病变切除程度,χ2检验比较全切除率。P<0.05为差异有统计学意义。
2 结果
2.1 术中情况
所有入组病例均接受功能神经导航和术中磁共振引导下行病变切除术。术中共扫描93次,所有患者扫描1~3次/例不等,平均1.4次/例。主刀医生对53例患者切除程度判断准确,余12例判断不准确,误判率为18.5%,其中误判的12例患者均是胶质瘤,其中高级别胶质瘤4例,低级别胶质瘤8例。
2.2 病理分类
入组的65例患者中,高级别胶质瘤33例(WHO Ⅲ级16例,Ⅳ级17例),低级别胶质瘤21例(WHO Ⅰ级1例,Ⅱ级20例),胶质瘤共54例,海绵状血管瘤6例,转移癌5例。
2.3 对切除程度的影响
2.3.1 非胶质瘤患者的影响
11例患者中,6例海绵状血管瘤,5例转移癌,术前平均体积29.5 cm3。术中磁共振首次扫描就确认病变切除完全。
2.3.2 对胶质瘤患者的影响
术前胶质瘤患者的平均体积是58.7 cm3。54例患者中33例有肿瘤残留,只有21例影像学全切除。
25例首次磁共振扫描发现有残留的患者,继续手术切除肿瘤,肿瘤的切除程度由87.3%提高到末次扫描的97.4%,因而残留肿瘤体积由8.8 cm3减小到2.2 cm3(P<0.001)。术中磁共振扫描后未做进一步手术的29例患者中,肿瘤的平均切除程度是96.2%。术中磁共振和功能神经导航使54例胶质瘤平均切除程度从92.1%提高到96.8%(P<0.001)。
2.4 评价语言功能
和术前相比,患者术后2周语言功能9例(13.8%)有好转,41例(63.1%)无明显变化,失语加重或新发失语15例(23.1%)。这15例为胶质瘤,有8例患者是磁共振扫描后未进一步切除的,另外7例是发现残留肿瘤进一步切除的(χ2=0.001,P=0.973)。术后长期随访,1例失访,1例胶质母细胞瘤复发死亡,其中2例患者存在长期失语(3.2%)。
2.5 典型病例
患者主因右下肢乏力半年入院。查体:右下肢肌力V-级,右上肢肌力V级。头颅磁共振:左侧基底节区强化明显占位性病变。功能神经导航和术中磁共振引导下左基底节区占位性病变切除术,术中扫描2次,末次磁共振扫描证实肿瘤全切除,术后3个月随访语言功能正常(图1~2)。
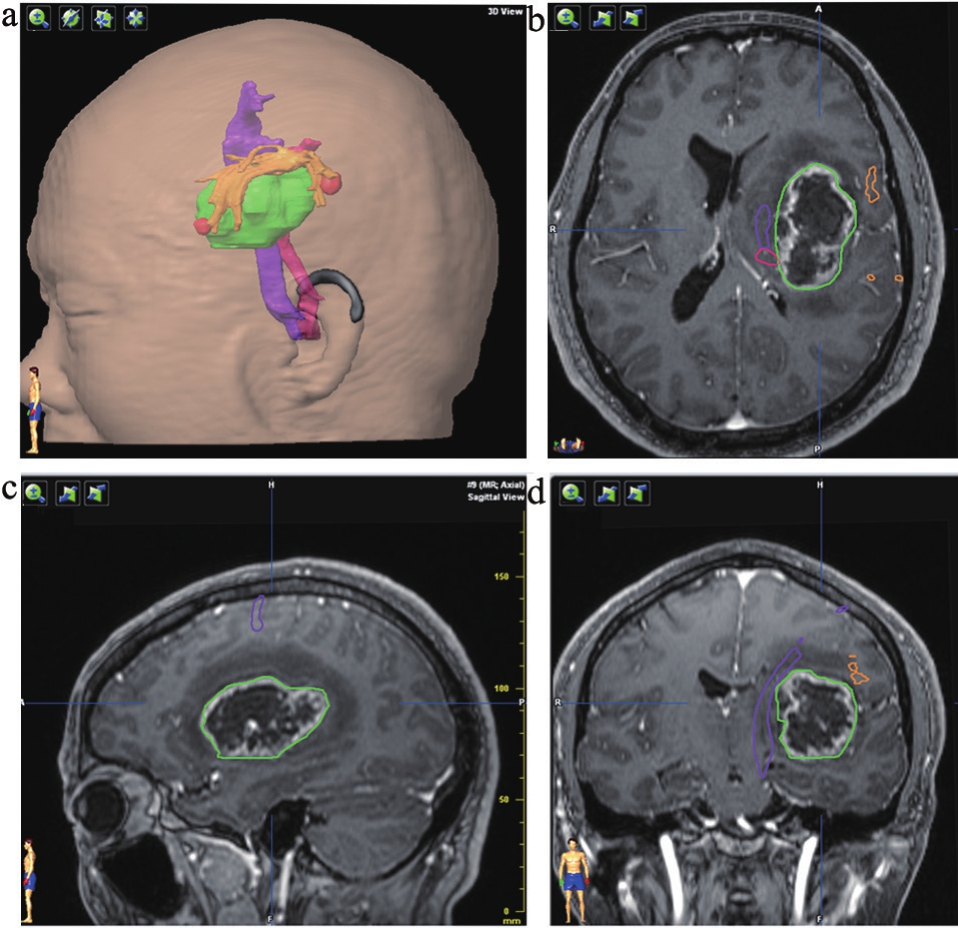
图1 病变累及优势半球语言传导束弓形束患者术前导航
注:术前计划,增强T1的增强范围标记肿瘤,锥体束(紫色)、感觉束(粉色)、弓形束(棕色)和肿瘤(绿色)关系密切,内侧推挤锥体束。BOLD-fMRI激活的Broca和Wernicke区与弓形束的皮层止点吻合。a.三维重建;b.轴位像;c.矢状位像;d.冠状位像。
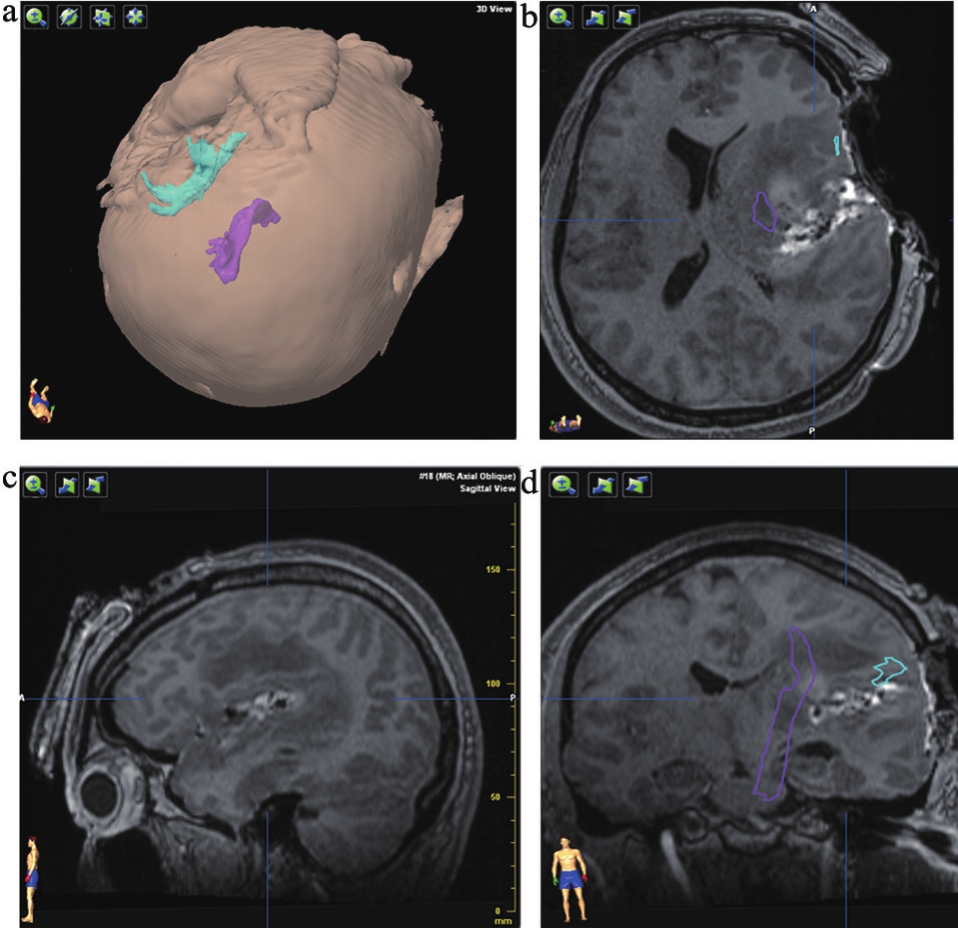
图2 术中扫描图像
注:术中重建锥体束和弓形束,弓形束和锥体束保留。病理:胶质母细胞瘤,WHOIV级。a.三维重建;b.轴位像;c.矢状位像;d.冠状位像。
3 讨论
随着计算机技术的进步和磁共振的发展,神经导航技术发展迅速,功能神经导航除了传统的解剖信息外,还有代谢信息和功能信息[3]。多模态功能神经导航所有的注册信息均为术前影像,神经外科手术过程中由于脑脊液流失、病变切除等因素,术中脑移位不可避免。多模态功能神经导航和术中影像是密不可分的,术中依赖术前功能和解剖影像指导手术是不够精准的,因此需要结合术中影像更新功能神经导航。除了术中磁共振外,术中CT和B超也可用于纠正术中脑移位,指导外科手术[4-7]。
McGirt等[8]研究10年间306例胶质母细胞瘤患者,术后无新发神经功能障碍患者的两年生存率为23%,而有语言功能障碍患者两年生存率为0,有运动障碍患者两年生存率为8%。术后有语言或运动障碍的患者,中位生存时间比无神经功能障碍患者少3个月。患者神经功能的保留对术后生活质量和生存时间是很重要的[9-10]。多模态功能神经导航可以使重要功能结构“可视化”,显微镜下导航可以给术者提供病变和重要功能结构的空间关系,避免损伤重要功能结构。
目前业内公认的定位语言区和传导束的“金标准”还是清醒开颅直接电刺激[11-15]。本组患者术后语言功能障碍发生率和清醒开颅直接电刺激类似,同时还能避免术中电刺激的流程复杂、易诱发癫痫等缺点。Bello等[16]皮层下电刺激指导语言区胶质瘤手术,88例患者短期语言功能障碍发生率为67.3%,永久语言功能障碍发生率为2.3%。我们入组的患者中,术后2周65例患者41例(63.1%)无变化,9例(13.8%)好转,15例(23.1%)原有症状加重或新发失语。2例(3.2%)患者存在长期语言功能障碍。
这15例原有症状加重或新发失语患者均为胶质瘤,7例为首次磁共振扫描发现残留进一步切除的,8例为扫描后未进一步切除的,两组资料统计分析,P=0.973,无统计学意义,说明进一步切除并没有增加术后出现语言功能障碍的风险。
4 结论
多模态功能神经导航和术中高场强磁共振有助于纠正术中脑移位,发现残留病变,更新导航进一步切除残留病变,提高病变全切率和切除程度,保护患者的语言功能。
[参考文献]
[1] Dea N,Fournier-Gosselin MP,Mathieu D,et al.Does extent of resection impact survival in patients bearing glioblastoma?[J].Can J Neurol Sci,2012,39(5):632-637.
[2] Chen X,Xu BN,Meng X,et al.Dual-room 1.5-T intraoperative magnetic resonance imaging suite with a movable magnet:implementation and preliminary experience[J].Neurosurg Rev,2012,35(1):95-109.
[3] Nimsky C,Kuhnt D,Ganslandt O,et al.Multimodal navigation integrated with imaging[J].Acta Neurochir Suppl,2011,109:207-214.
[4] Senft C,Bink A,Franz K,et al.Intraoperative MRI guidance and extent of resection in glioma surgery: a randomised, controlled trial[J].Lancet Oncol,2011,12(11):997-1003.
[5] Kuhnt D,Becker A,Ganslandt O,et al.Correlation of the extent of tumor volume resection and patient survival in surgery of glioblastoma multiforme with high-field intraoperative MRI guidance[J].Neuro Oncol,2011,13(12):1339-1348.
[6] Chibbaro S,Tacconi L.Image-guided microneurosurgical management of vascular lesions using navigated computed tomography angiography. An advanced IGS technology application[J].Int J Med Robot,2006,2(2):161-167.
[7] Unsgaard G,Ommedal S,Rygh OM,et al.Operation of arteriovenous malformations assisted by stereoscopic navigation-controlled display of preoperative magnetic resonance angiography and intraoperative ultrasound angiography[J].Neurosurgery,2005,56(2):281-290.
[8] McGirt MJ,Mukherjee D,Chaichana KL,et al.Association of surgically acquired motor and language deficits on overall survival after resection of glioblastoma multiforme[J].Neurosurgery,2009,65(3):463-469.
[9] Jakola AS,Gulati S,Weber C,et al.Postoperative deterioration in health related quality of life as predictor for survival in patients with glioblastoma: a prospective study[J].PLoS One,2011,6(12):28592.
[10] Fujii M,Maesawa S,Motomura K,et al.Intraoperative subcortical mapping of a language-associated deep frontal tract connecting the superior frontal gyrus to Broca’s area in the dominant hemisphere of patients with glioma[J].J Neurosurg,2015,122(6):1390-1396.
[11] Southwell DG,Riva M,Jordan K,et al.Language outcomes after resection of dominant inferior parietal lobule gliomas[J].J Neurosurg,2017,127(4):781-789.
[12] Huberfeld G,Trébuchon A,Capelle L,et al.Preoperative and intraoperative neurophysiological investigations for surgical resections in functional areas[J].Neurochirurgie,2017,63(3):142-149.
[13] Alimohamadi M,Shirani M,Shariat Moharari R,et al.Application of awake craniotomy and intraoperative brain mapping for surgical resection of insular gliomas of the dominant hemisphere[J].World Neurosurg,2016,92:151-158.
[14] Motomura K,Natsume A,Iijima K,et al.Surgical benefits of combined awake craniotomy and intraoperative magnetic resonance imaging for gliomas associated with eloquent areas[J].J Neurosurg,2017,127(4):790-797.
[15] Mazerand E,Le Renard M,Hue S,et al.Intraoperative subcortical electrical mapping of the optic tract in awake surgery using a virtual reality headset[J].World Neurosurg,2017,97:424-430.
[16] Bello L,Gallucci M,Fava M,et al.Intraoperative subcortical language tract mapping guides surgical removal of gliomas involving speech areas[J].Neurosurgery,2007,60(1):67-80.
Protective Effect of Multimodal Navigation and Intraoperative Magnetic Resonance Imaging on Language Function in Cerebral Lesions Involving Language Area
LI Fangye, CHEN Xiaolei, HOU Yuanzheng, SUN Guochen, ZHANG Jiashu, YU Xinguang, XU Bainan
Department of Neurosurgery, Chinese PLA General Hospital, Beijing 100853, China
Abstract:ObjectiveTo evaluate the impact of multimodal navigation and intraoperative magnetic resonance imaging (iMRI)on extent of resection, gross total resection and preservation of language function.MethodsA total of 65 patients with cerebral lesions involving arcuate fasciculus (AF) were enrolled. Impact of multimodal navigation and iMRI on surgical strategies, extent of resection, rate of gross total resection (GTR) and language function were analyzed.ResultsExtent of resection was overestimated in 12 cases (18.5%) by the neurosurgeons, compared with the first iMRI. The first iMRI confirmed total resection of non-glioma lesions. First iMRI demonstrated gross total resection in 21 patients and incomplete resection in 33 cases. Further resection was continued with updated imaging in 25 patients. Additional tumor resection in 25 cases increased extent of resection from 87.3%to 97.4%, resulting in improvement of mean resection degree in glioma cases from 92.1% to 96.8%. Compared with preoperative language function status, 15 cases (23.1%) got new or worsened language dysfunction 2 weeks after surgery. At 6-month followup, only 2 patients had a permanent postoperative language deficit.ConclusionMultimodal navigation and iMRI help maximal resection of cerebral lesions while minimum injury to language function, which can improve health related quality of life.
Key words:multimodal navigation; intraoperative magnetic resonance imaging; language; diffusion tensor tractography; arcuate fasciculus
[中图分类号]R445.2
[文献标识码]A
doi:10.3969/j.issn.1674-1633.2017.12.003
[文章编号]1674-1633(2017)012-0011-04
收稿日期:2017-11-17
基金项目:国家自然科学基金(81771481);解放军总医院科技创新苗圃基金(16KMM14);解放军总医院临床科研扶持基金(2017FC-TSYS-2012)。
通讯作者:陈晓雷,主任医师,副教授,硕士生导师,主要研究方向为高场强术中磁共振及功能神经导航技术和神经内窥镜技术。
通讯作者邮箱:chxlei@mail.sysu.edu.cn
本文编辑 王静