低剂量双源CT头颈主动脉联合扫描的可行性及在A型主动脉夹层的临床应用价值
赵宏亮a,郑敏文a,段维勋b,李剑a,石明国a,王晋c
第四军医大学西京医院 a.放射科;b.心血管外科;c.放射医学教研室,陕西 西安 710032
[摘 要]目的分析急性A型主动脉夹层(Acute Type A Aortic Dissection,ATAAD)术前CT血管造影(CT Angiography,CTA)头颈主动脉联合扫描的可行性及临床价值。方法 连续收集133例临床可疑ATAAD患者,接受头—盆腔CTA扫描。扫描参数:管电压80 kV,参考管电流300 mAs,开启自动管电流调控。记录每例患者容积CT剂量指数(CT Dose Index Volume,CTDIvol)及剂量长度乘积(Dose-Length Product,DLP);对每例病例进行图像主观质量评分;评估与手术相关的头颈部血管CTA征象及颅内Willis环变异。结果经临床或CTA证实的ATAAD患者共123例。123例患者的平均CTDIvol为(3.4±0.3)mGy;DLP为(314.1±29.3)mGy·cm。123例图像均满足诊断,图像质量计分为(1.18±0.40)分。头颈部CTA检出:夹层撕裂累及颈部血管58例(47.2%)、一侧颈动脉密度减低10例(8.1%)、颈动脉粥样硬化斑块15例(12.2%)、椎动脉发育不良12例(9.8%)、左椎动脉起自主动脉弓4例(3.3%)、右迷走锁骨下动脉3例(2.4%)、颅内动脉狭窄19例(15.5%)及颅内动脉瘤7例(5.7%);与手术相关的颅内willis环解剖变异共检出57例(46.3%)。结论头颈主动脉联合扫描低辐射剂量CTA扫描是可行的。头颈部动脉的增量信息为临床手术治疗可提供重要依据。
[关键词]主动脉夹层;CT血管成像;低辐射剂量;颈部血管
引言
急性A型主动脉夹层(Acute Type A Aortic Dissection,ATAAD)神经系统并发症术后常见且是术后致死致残的主要原因[1]。术前颅脑低灌注或患者Willis环不完整,是术后神经系统损伤的危险因素[2]。故术前明确患者的头颈部血管情况及解剖变异十分重要。
本实验拟采用双源CT低辐射剂量头颈主动脉联合扫描,评价其可行性及对临床治疗的指导价值。
1 资料与方法
1.1 一般资料
连续收集2015年1月1日~2016年5月30日期间在我院临床拟诊的A型主动脉夹层患者133例,给予从头到盆腔动脉一次性CTA成像。最终经CTA及临床等确诊为急性A型主动脉夹层患者123例纳入评价。CTA检查排除标准:对含碘对比剂过敏者;严重肝、肾功能不全者;孕妇;拒绝本实验的患者。
1.2 CT扫描方法和图像后处理
所有扫描采用Siemens 二代双源CT。扫描范围:颅顶至盆腔入口;采用前瞻性心电门控大螺距扫描,应用造影剂跟踪法,在左心房内选择感兴趣区监测CT值,当感兴趣区内CT值达到100 HU时,延迟11 s自动触发扫描。对比剂采用非离子对比剂碘普罗胺注射液(370 mgI/mL),注射量为1.2 mL/kg,注射流率5.0 mL/s,对比剂注射完立即注射20~50 mL生理盐水。扫描参数:管电压80 kV,参考管电流300 mAs,自动毫安控制技术(CARE Dose 4D,Siemens),螺距3.2,准直2 mm×64 mm×0.6 mm,层厚1.0 mm,重建间隔0.8 mm。矩阵512×512,显示野(FOV)200~320 mm,重建核B26f。所有原始数据传至西门子工作站进行图像后处理。
1.3 辐射剂量评估
记录每例患者的容积CT剂量指数(Volume CT Dose Index,CTDIvol)和相应剂量长度乘积(Dose-Length Product,DLP)。
1.4 主观图像质量评价
由2名高年资心血管CT诊断医师对横断位图像以及重建图像进行盲法评价,意见不统一时共同商议确定最终评分。对每一病例分别对头、颈、胸、腹各部分动脉血管进行评价。评分采用3分级法[3]:1分,血管显示极好,边界清晰,噪声值极小;2分,血管显示良好,噪声值小;3分,血管显示不清,噪声值大,无法诊断。
1.5 与手术相关的头颈动脉CTA征象
(1)颈部动脉:① 夹层撕裂累及;② 一侧颈动脉密度减低;③ 动脉粥样硬化斑块;④ 发育不良及起源异常:发育不良定义为直径小于2.2 mm[4];⑤ 变异。
(2)颅内动脉:大脑前动脉、大脑中动脉及大脑后动脉狭窄(>50%)及动脉瘤(血管内径>1.5倍正常管径)。
(3)与术中脑灌注方式相关的颅内Willis环变异:共7种类型[5]。
1.6 统计学分析
采用SPSS 19.0软件进行统计学分析,计量资料均表示为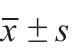 或百分比。
或百分比。
2 结果
2.1 患者的一般资料
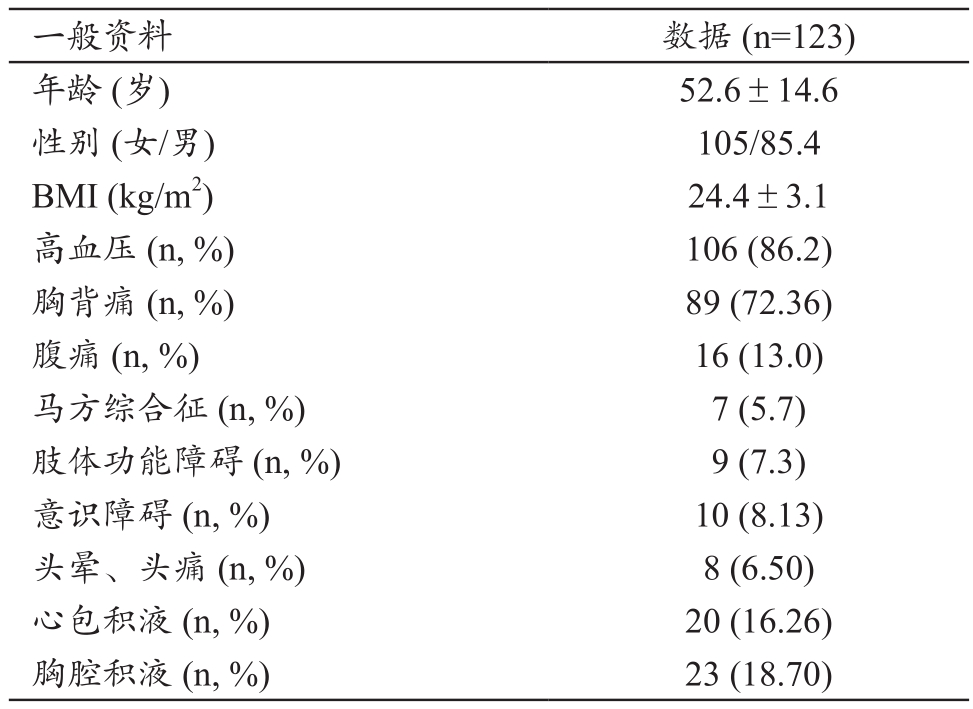
123例ATTD患者均扫描成功,无不良反应。患者的一般资料、临床特征及体征结果,见表1。
表1 ATAAD患者的一般资料
2.2 辐射剂量
123例患者的平均CTDIvol为(3.4±0.3)mGy;DLP为(314.1±29.3)mGy·cm。
2.3 图像质量评分
123例患者图像质量均满足诊断,不同部位血管的主观图像评分平均值分别为:大脑中动脉为(1.40±0.45)分;颈总动脉为(1.07±0.23)分;升主动脉为(1.21±0.63)分;胸主动脉为(1.09±0.40)分;腹主动脉为(1.10±0.00)分;合计为(1.18±0.40)分。
2.4 ATTD患者颈部血管CT异常表现
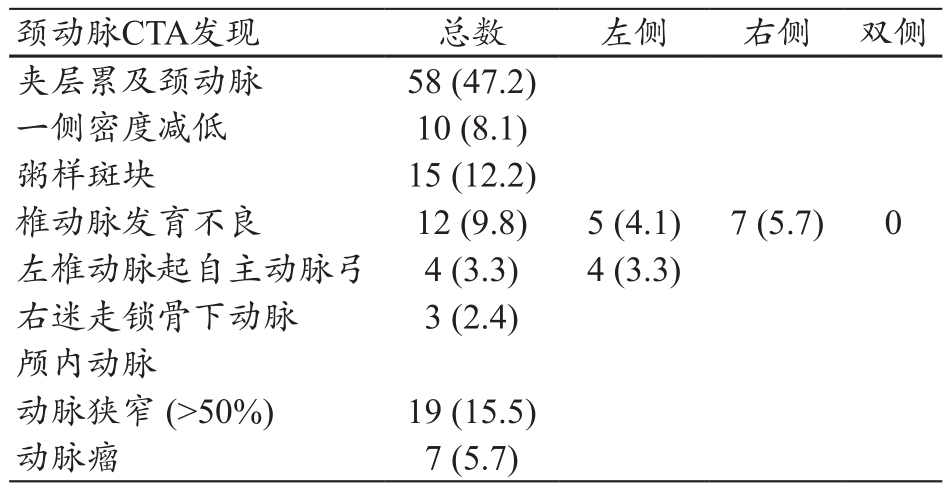
与手术相关头颈动脉CTA征象,见图1~2、表2。颈动脉撕裂以无名动脉—右侧颈总动脉撕裂受累最常见(图2a)。一侧颈动脉血管密度减低以颈内动脉最常见(图2b)。此外,1例患者颈总动脉为假腔供血。颅内动脉狭窄>50%检出率达15.5%(19/123),颅内动脉瘤检出率为 5.7%(7/123)(图 2c)。
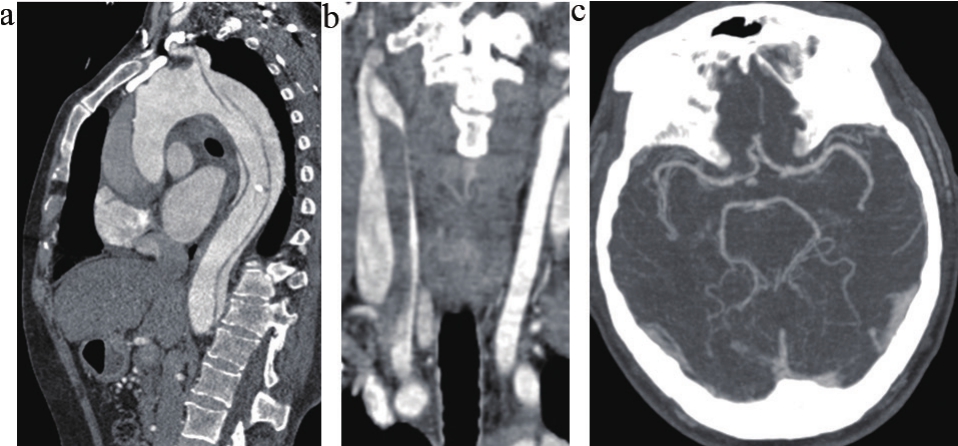
图1 主动脉夹层头颈部CTA图
注:患者男性56岁,胸背痛4 h急诊入院。a.主动脉A型夹层;b.右侧颈总动脉全程撕裂,真腔重度狭窄;c.Willis环显示前交通动脉及双侧后交通动脉均缺如,属于变异第6种类型。术前患者因右颈总动脉撕裂真腔狭窄,右侧大脑半球处于低灌注状态,急诊外科手术因Wiliis环变异(前交通动脉及双侧后交通动脉均缺如),左侧大脑半球术中将处于极低灌注或无灌注,患者术后出现严重的神经系统并发症。

图2 颈部血管CT异常表现
注:a.冠状位示主动脉A型夹层累及右侧颈总动脉全程,右颈总动脉远心端再破口;b.冠状位显示右颈总动脉-颈内动脉全程密度明显减低;c.VR图示椎基底动脉动脉瘤样扩张。
表2 ATTD患者颈部血管CT异常表现 [n=123,例数 (%)]
2.5 与术中脑灌注方式相关的颅内Willis环变异
123例患者中共检出Willis环变异28例,总检出率为46.3%(28/123),其中1型最多(22.8%);此型患者如术中深低温停循环并单侧脑灌注时左侧大脑中动脉供血区脑实质处于缺血状态;6型(0.8%)最少;见表3。在Willis环变异中5、6、7型患者术中将大面积,甚至一侧大脑半球处于缺血状态。
表3 与脑灌注不良相关的颅内动脉(Willis环)CT异常分型(n=123)
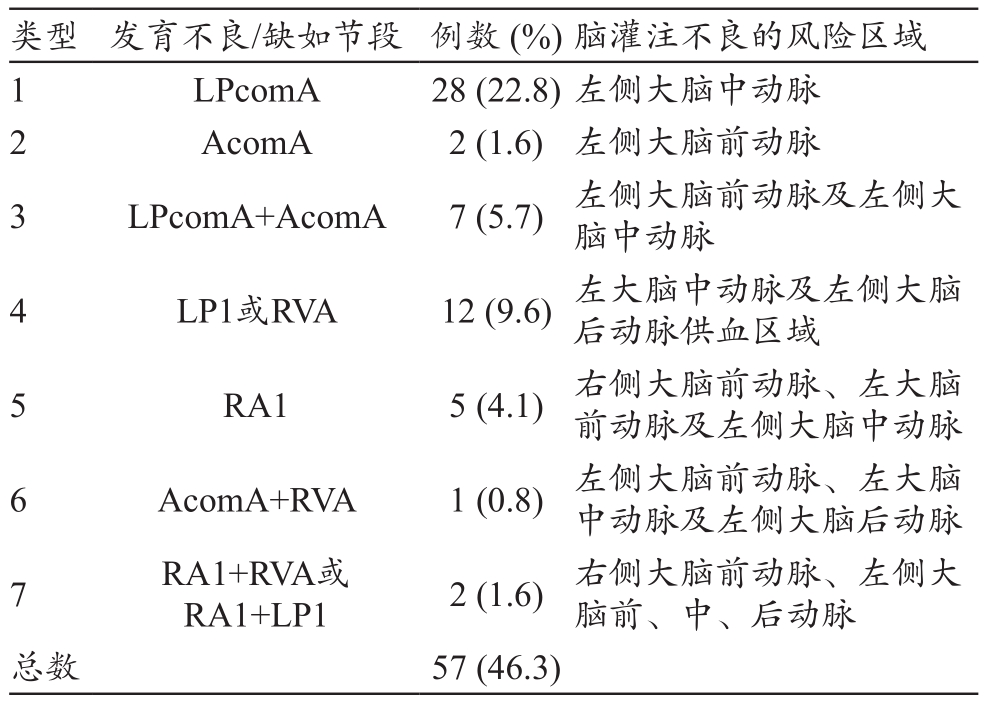
注:AcomA=前交通动脉;L=左侧;PcomA=后交通动脉;P1=大脑后动脉近段;R=右侧;A1=大脑前大动脉近段;VA=椎动脉。
3 讨论
急性主动脉夹层起病急,若未经干预,48 h患者死亡率高达50%。一旦确诊需急诊外科手术[6]。多层螺旋CTA是确诊ATAAD主要的检查手段之一[3]。主动脉弓上分支夹层及Willis环解剖变异是导致术中颅脑缺血的危险因素[5-6]。以往A型主动脉夹层患者先行主动脉CTA确诊后,如需了解头颈部血管情况再辗转超声、MR检查或分次再行CTA检查(因传统CT扫描长度及速度影响无法一次完成),这对于危重患者十分不利[7]。第二代双源CT,随着空间、时间分辨率的提高,一站式大范围成像成为现实[8-9]。
吴任国等[10]对主动脉夹层患者行回顾性心电门控全主动脉CTA扫描,管电压120 kV,管电流200 mAs,并联合使用ECG剂量调节技术,得到的DLP为655.9 mGy·cm。我们的研究采用双源CT Flash扫描,且管电压降至80 kV,辐射剂量大大减低并图像质量均满足诊断,因此本实验采用的低辐射剂量参数进行头颈主动脉联合扫描是可行的。
ATAAD患者脑缺血和栓塞是造成该病术后神经功能障碍的主要原因[10-12]。对于主动脉夹层患者术前合并脑缺血时,术中需密切关注并调控血压以防破裂或脑出血。本研究中检出的,如颈总动脉撕裂、一侧动脉密度减低或动脉狭窄等征象可预示患者合并颅内缺血。颈动脉的粥样斑块脱落会增加动脉栓塞的风险。故当A型主动脉夹层术前合并上述征象时,术者更应尽量缩短手术时间、管控血压,以减少术后脑部并发症的发生。
本研究中所有患者的Willis环显示满意。单侧脑灌注是目前主要外科手术术中脑保护方式,但当Willis环发育不全时,单侧脑灌注则会导致颅脑部分脑组织会缺氧缺血[13]。对于ATAAD术前明确Willis环的解剖特点十分重要。本研究中检出约46.3%的Willis环存在缺血性发育不完整,如术中采用单侧脑灌注,将会增大术后神经并发症的风险[14-16]。当ATAAD夹层合并颈总动脉撕裂,且伴有Willis环不完整时,此类患者建议采用双侧脑灌注方式。
本研究首次提出对ATAAD患者进行头—全主动脉CTA扫描方案,新的扫描方案可缩短患者术前检查时间,减少危重患者辗转检查的风险。对于增量的头颈部血管CTA影像信息更有助于临床医生对于下一步治疗提供可靠依据。
[参考文献]
[1] Morimoto N,Okada K,Okita Y.Lack of neurologic improvement after aortic repair for acute type A aortic dissection complicated by cerebral malperfusion: predictors and association with survival[J].J Thorac Cardiovasc Surg,2011,142(6):1540-1544.
[2] 邓宏平,陈蕾,王志维,等.单、双侧脑灌注技术在主动脉外科手术中脑保护效果的比较[J].武汉大学学报(医学版),2016,37(1):127-130.
[3] 李剑,宦怡,赵宏亮,等.双源CT心电门控和非门控大螺距主动脉成像质量与辐射剂量的对照研究[J].中华放射学杂志,2013,47(4):301-304.
[4] Hiratzka LF,Bakris GL,Beckman JA,et al.2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM guidelines for the diagnosis and management of patients with thoracic aortic disease: executive summary[J].J Am Coll Cardiol,2010,55(2):279-315.
[5] Papantchev V,Stoinova V,Aleksandrov A,et al.The role of Willis circle variations during unilateral selective cerebral perfusion: a study of 500 circles[J].Eur J Cardio-Thoracic Surg,2013,44(4):743-753.
[6] 杨遇春,陈国洪,刘成伟.主动脉腔内隔绝术后脑缺血发作的原因分析与处置对策-附病例3例[J].岭南心血管病杂志,2011,(1):148.
[7] Apaydin AZ,Islamoglu F,Askar FZ,et al.Immediate clinical outcome after prolonged periods of brain protection:retrospective comparison of hypothermic circulatory arrest,retrograde, and antegrade perfusion[J].JCS,2009,24(5):486-489.
[8] Hoksbergen AW,Legemate DA,Ubbink DT,et al.Collateral variations in circle of Willis in atherosclerotic population assessed by means of transcranial color-coded duplex ultrasonography[J].Stroke,2000,31(7):1656-1660.
[9] Furtado AD,Adraktas DD,Brasic N,et al.The triple rule-out for acute ischemic stroke: imaging the brain, carotid arteries, aorta,and heart[J].AJNR,2010,31(7):1290-1296.
[10] 吴任国,唐秉航,李良才,等.容积CT结合ECG剂量调节在主动脉夹层中的应用[J].放射学实践,2013,28(10):1021-1024.
[11] Khaladj N,Shrestha M,Meck S,et al.Hypothermic circulatory arrest with selective antegrade cerebral perfusion in ascending aortic and aortic arch surgery: A risk factor analysis for adverse outcome in 501 patients[J].J Thorac Cardiovasc Surg,2008,135(4):908-914.
[12] Malvindi PG,Scrascia G,Vitale N.Is unilateral antegrade cerebral perfusion equivalent to bilateral cerebral perfusion for patients undergoing aortic arch surgery?[J].Interact Cardiov Th Surg,2008,7(5):891-897.
[13] Furtado AD,Adraktas DD,Brasic N,et al.The triple rule-out for acute ischemic stroke: imaging the brain, carotid arteries, aorta,and heart[J].AJNR Am J Neuroradiol,2010,31(7):1290-1296.
[14] Wang Z,Chen Y,Wang Y,et al.Feasibility of low-dose contrast medium high pitch CT angiography for the combined evaluation of coronary, head and neck arteries[J].PloS One,2014,9(3):e90268.
[15] Misfeld M,Leontyev S,Borger MA,et al.What is the best strategy for brain protection in patients undergoing aortic arch surgery?A single center experience of 636 patients[J].Ann Thorac Surg,2012,93(5):1502-1508.
[16] 阳晟,任长伟,许尚栋,等.主动脉弓部手术中单侧大脑灌注血流变化与神经系统并发症关系的分析[J].心肺血管病杂志,2012,31(5):509-512.
Clinical Application of Low-Dose Dual-Source of Cerebral and Carotid Arteries During Aortic CT Angiography in Type A Aortic Dissection
ZHAO Honglianga, ZHENG Minwena, DUAN Weixunb, LI Jiana, SHI Mingguoa, WANG Jinc
a.Department of Radiology; b.Department of Cardiovascular Surgery; c.Office of Radioactive Medicine, Xijing Hospital, The Fourth Military Medical University, Xi’an Shaanxi 710032, China
Abstract:ObjectiveTo evaluate the low-dose dual-source head, neck and aorta CT angiography (CTA) in assessing the arteries of type A aortic dissection (ATAAD).MethodsLow-dose head, neck and CTA were performed in 133 consecutive patients with suspected ATAAD. The volume CT dose index (CTDIvol) and dose-length product (DLP) were obtained for all scans. Subjective image quality of intracranial, cervical, thoracic and abdominal arteries were assessed. In addition,the surgery related CTA features as well as the Willis circle variations were recorded and analyzed.ResultsOne hundred and twenty-three patients with definite diagnosis of ATAAD were enrolled in this study. Mean CTDIvol and DLP for all patients were (3.4±0.3) mGy and (314.1±29.3) mGy·cm. The detection rates of interlayer tearing involved in cervical artery(n=58), decreased lateral carotid artery density (n=10), carotid atherosclerotic plaque (n=15), dysplasia of vertebral artery (n=12),left vertebral artery with autonomic arterial arch (n=4), right vagus subclavian artery (n=3), intracranial arterial stenosis (n=19) and intracranial aneurysm (n=7) were 47.2%, 8.1%, 12.2%, 9.8%, 3.3%, 2.4%, 15.5% and 5.7% respectively. The Willis circle anatomic variation was found in 57 (46.3%) patients.ConclusionA combined CTA of head, neck and aorta in ATAAD is feasible. The incremental craniocervical information may lead to improved clinical outcomes.
Key words:aortic dissection; CT angiography; low-dose dual-source; cervical vessels
[中图分类号]R814.42
[文献标识码]A
doi:10.3969/j.issn.1674-1633.2017.11.003
[文章编号]1674-1633(2017)11-0008-04
收稿日期:2017-08-10
基金项目:国家重点研发计划(2016YFC1301900);西京医院学科助推计划(XJZT14203)。
通讯作者:王晋,教授,主要研究方向为医学放射学。
通讯作者邮箱:wangjinn@fmmu.edu.cn
本文编辑 王静