光电医学精确检测-针对大肠肿瘤转移的早期检测芯片研发
林启万1,魏世忠1,赵喜红2,魏淑鉁3,张家祯1
1. 国立台湾大学 医学工程研究,台湾台北 100;2. 武汉工程大学 化工与制药学院,湖北 武汉 430205;3. 国立台湾大学附属医院,台湾 台北 100
[摘 要]本研究的主要目的是为临床医生提供判别大肠直肠癌病人转移风险的检测工具,以协助医生选择合适的治疗方式。首先笔者结合轴向偏振雷射光与扫描式等离子显微术,完成具次微米解析力的等离子显微系统,其对于两纳米结构边缘距离及单颗纳米粒子的解析能力可达800 nm,而对于等效折射率变化的解析力可达10-4。此系统结合纳米阵列芯片可应用在低于250 pg/mL的胎盘生长因子(PlGF)检测,其已证实为大肠直肠癌重要的转移标记。此外笔者针对KRAS基因突变检测,设计出PNA clamp SMAP-2 assay,搭配本实验室开发的便捷式红外表面电离子系统及聚合塑料芯片,可成功在30 min内鉴别KRAS突变株与原生株。
[关键词]大肠直肠癌; 胎盘生长因;KRAS; 表面等离子共振
依据世界卫生组织(WHO)的统计,2008年全世界约有1,200,000个大肠直肠癌(Colorectal Cancer,CRC)新病患产生,并且有608,700个死亡案例[1]。根据台湾行政院卫生福利部中央健康保险局数据显示,大肠直肠癌自2006年起,罹癌人数首次突破万人,至2008年,其罹癌人数已连续3年居10大癌症之冠。而2011年行政院卫生福利部国民健康署的癌症登记报告中,结肠、直肠、乙状结肠连接部及肛门罹癌人数(含原位癌)已达15,315人,其发生率在男性癌症中为第一名,女性第二名,死亡位居第三位,当年共有4,921人死于此类癌症。预计到2017年为止,台湾罹患大肠癌人数将以每年3.9%的速度增加。而在中国大陆,根据2013年肿瘤登记年报,2013年农村地区CRC发生率为16.98/105,而城市地区更攀升至31.17/105,成为发生率第三名的癌症,而CRC在两性间的恶性肿瘤占比分别为男性9.39%,女性9.68%。随着近年来生活及饮食方式的改变,肠胃等消化系统癌症的发病率已逐年升高[2-4],CRC近年在世界各国的盛行率更是不断攀升(美国66%、日本45%,台湾42%),根据美国国家卫生研究院(National Institutes of Health)的统计结果[5],2014年大肠癌预期发生率在美国地区排名第四,而预期死亡率却高居第二。综上所述,大肠癌不仅发生率高,其死亡率也偏高[6]。虽然初期诊断出大肠癌患者的5年存活率高达89.8%,但超过半数的大肠癌患者是于第二期或第三期才被诊断接受治疗,而其中部分患者易有转移复发的情形而降低存活率[2-3]。因此,如何能协助临床人员针对不同大肠癌的癌症分期以及不同病灶发生的位置做一个适当的预后评价(Prognostic),进而给予客制化的治疗,以改善存活率,是一个重要的问题。
鉴于大肠直肠癌在华人社会的高盛行率,此类疾病的基础医学与临床诊疗问题,仍有许多空间可望借由生医光电平台技术的整合与创新的光电诊断治疗方法进一步的改善,进而提供一个兼具创新科研与产业发展的契机,特别是对于当前CRC检测中存在灵敏度较低、检测项目单一、耗时较长、成本较高等问题,采用如表面等离子共振(Surface Plasmon Resonance,SPR)的新型光电检测元件,来构建新型高灵敏度高通量可抛弃式SPR阵列芯片来取代传统检测方法,进行早期CRC转移的诊断与个性化诊疗(Early Diagnosis for Personalized Therapy),达到临床应用上能为患者带来更好的诊断及治疗的策略,进而改善大肠直肠癌患者的存活及预后的期望。
1 大肠直肠癌肿瘤标记
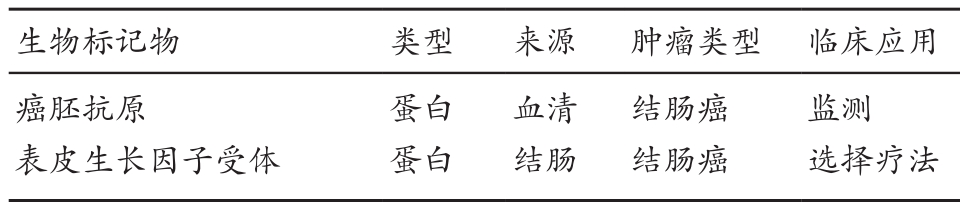
随着基因体学、蛋白质体学以及分子病理学等研究的进步,有越来越多的肿瘤标志物(Tumor Biomarker)已逐渐作为临床预后评价标准以协助癌症治疗的选择[7],表1为美国食品药物管理局(Food and Drug Administration)所认可的癌症标志物,以大肠癌为例,包含了癌胚抗原(Carcinoembryonic Antigen,CEA)和上皮细胞生长因子受主(Epidermal Growth Factor Receptor,EGFR),两种蛋白质标志物,分别作为大肠癌检测指标以及临床治疗选择的参考依据。
表1 美国食品药物管理局认可的CRC癌症标志物[7]
近年来,许多研究也逐渐发现多种新的大肠癌标志物[8],期望透过多种的癌症标志物的综合表现量来做为大肠癌检测以及预后评价的重要参考因子。例如台大医院的魏淑珍医生于2009年时提出胎盘生长因子(Placenta Growth Factor,PlGF)表现量增加的病患其预后有较差的趋势[9]。其研究主要以酵素免疫分析法(Enzyme-linked Immunosorbent assay,ELISA)分析86位大肠癌病患术前血清以及30位对照组健康人血清。其研究结果指出在大肠癌患者血清中,PlGF数值偏高而可溶性血管内皮生长因子受主(Soluble VEGFR-1,sFlt-1)则偏低。以86位大肠癌患者血清中PlGF浓度中位数(20.6 pg/mL)作为阀值(Threshold),统计结果显示于术前血清中的PlGF浓度高于阀值的患者,其复发率和死亡率偏高。此外,根据大肠癌第三期患者的统计结果,其术前血清中的PlGF与存活率的关系较CEA更高,与癌胚抗原(CEA)和VEGFR等其他可能影响因子相互比较后,PlGF以及sFlt-1对于复发的预后评价可视为一个独立危险因子,并作为大肠癌检测的肿瘤标记,其中又以PlGF最适合做为复发和存活率评价因子。而在大肠直肠癌靶向治疗方面,经过超过30年的广泛研究,已经证明KRAS基因(V-Kiras2 Kirsten Rat Sarcoma Viral Oncogene)可作为抗上皮细胞生长因子受体治疗反应(Anti-EGFR Treatment)的负相关因子。KRAS基因的突变是人类癌症中最普遍存在的突变类型,30%的人类癌症中可以发现KRAS基因突变。由于标靶治疗的高成本及潜在毒性,针对KRAS基因突变的检测已经成为转移性大肠直肠癌病人非常重要的药物选择参考依据。KRAS基因可转译出在EGFR信号传递途径中一21KDa大小的GTP结合蛋白。在35%~45%的CRC病人中,此基因在外显子(exon)12和13密码位置有活跃的突变,并且会造成EGFR抑制剂治疗的无效化[10]。此突变已被视为临床评价anti-EGFR治疗是否进行的重要标记[11]。因此发展迅速准确的KRAS突变检测技术将是重要的课题。传统上用于检测此突变的标准程序乃是透过基因定序[12],然而针对基因直接进行定序不仅过程复杂且耗时,以治疗前筛检的标准来看,更是所费不赀的检测方式。此外,由于临床样本常混有大量未突变细胞,常造成突变基因在直接定序中的漏筛[13]。在过去10年中,科学发展了许多KRAS突变检测的方法,包含限制片段长度多态性聚合酶连锁反应(Polymerase Chain Reaction-Restriction Fragment Length Polymorphism,PCR-RFLP),聚合酶连锁反应单链构象多态性(Single-strand Conformation Polymorphism,PCR-SSCP),突变等位基因扩增(Mutant-Allele-Specific Amplification)变异体富集聚合酶连锁反应(Mutation Enrichment Assays)[13-14],高解析度熔点分析(High Resolution Melting Analysis)[15]和其他方法[16]。其中有些技术已经被证明具有较直接定序更高的准确率和敏感度,但是大部分仍然具有实验步骤复杂、耗费时间长、高成本、样本来源限制多等不适合临床常规检查使用的缺点。
2 表面等离子共振检测技术
表面等离子共振技术具有光学非接触性与高灵敏度的非标记性检测特点,当光在介质与金属薄膜界面发生全反射时,所产生的渐逝波引起金属自由电子振荡,若其入射光与渐逝波波速相等的情况下,产生的共振现象即为表面等离子共振[17-19]。若与金属薄膜接触的介质层折射率产生变化,则会改变界面的等离子共振条件,此技术可在数百纳米的深度下有极佳的灵敏度[20]。在生物感测器的使用上,若样本中的生物分子与事先固定于金属薄膜上的对应生物分子进行配对时,会造成金膜表面等效折射率改变,并经由共振角、共振波长、相位或是固定波长和角度下的强度变化建立检量线。若使用图像式呈现表面等离子共振现象,可以提供使用者更直观的视觉方式来观测标的物体。然而目前大多数图像式表面等离子图像的分辨率却局限于数微米以上。例如物镜反射式表面等离子共振显微镜,由物镜后孔一侧导入入射光在聚焦处达到共振角以激发表面等离子共振,经由反射后由物镜后孔另一侧接收。此技术虽然可用于观察小范围的细胞或病毒图像,但仍受限于表面等离子横向传递现象而产生横向失真,并使解析率无法优于3 µm[21-22]。为了提高横向分辨率,Kano与其研究团队[23]于2000年时提出透过高数值孔径的物镜聚焦的扫描式等离子共振显微镜(Scanning SPR Microscopy,sSPRM)。单波长光源经由多角度入射并聚焦于玻璃与金属薄膜界面,在符合共振角且以TM mode入射的条件下激发表面等离子共振。Kano以线性偏振(Linear Polarization)的雷射光填满物镜后孔径(Back Aperture),经物镜聚焦后于焦点产生一对称的TM mode入射,并激发表面等离子共振。若于物镜后孔径处的傅立叶平面(Fourier Plane)接收聚的焦点傅立叶图像(Fourier Image),于TM mode入射方向的对应位置,会因金属表面的等离子耦合现象而在傅立叶图像产生消光黑色圆弧对;该对圆弧的半径和后孔径图像最大半径可以对比至表面等离子共振角正弦值跟物镜最大入射角正弦值。然而以线性偏振光聚焦后因干涉所产生的表面等离子共振波并非为一个单一峰值,根据表面等离子共振波近场模拟结果,等离子共振于焦点处沿着TM mode入射方向产生相消性干涉,而导致共振波焦点中心的电场强度相抵销,最终于焦点两侧产生一对共振波峰。若使用632.8 nm的红光,此表面等离子共振波峰对的峰距为330 nm[24]。因此若扫描极小的物体,影像将受两个旁瓣波峰的影响。
Zhan[25]于2006年,以理论模型证实轴向偏极光聚焦于银薄膜上所产生的表面等离子共振波为一个渐逝的贝赛尔函数(Evanescent Bessel Function),根据其理论计算其半高全宽为0.343l波长。若使用近红外光则金薄膜上的表面等离子感测探针直径大小约可达305~330 nm[26]。透过轴向偏振(Radial Polarization)入射光,使物镜聚焦时使各个方向上的入射光皆为TM mode,并于聚焦点中心处产生一个建设性干涉的表面等离子共振波,于TM mode入射方向的对应位置,会因金属表面的等离子耦合现象而在傅立叶图像产生消光黑色圆环。Watanabe等[24]于2007年时以此技术于54 nm的银薄膜上扫描直径175 nm的单颗纳米球,分别以波长632.8 nm的线性偏振光与轴向偏振光入射至数值孔径1.4的物镜激发表面等离子,经由二维自动化的扫描与傅立叶图像同步撷取分析后,重建出表面等离子共振角图像。以线性偏振光激发的等离子图像,呈现两个旁瓣且峰对峰距离为330 nm的表面等离子共振角图像,而以轴向偏振光扫描则呈现直径为220 nm的球形表面等离子共振角图像显示借由轴向偏振光不仅可形成单一等离子共振波峰,更可以提升影像整体空间解析度,以应用于纳米尺度或微纳米尺度的造影。目前文献中以物镜取代棱镜耦合的图像式表面等离子共振显微镜大多数应用于细胞表面吸附[27-28]、双脂质层[29]、病毒[22]、纳米粒子物化性[30]等生物医学研究。为提升现行于肿瘤标记检测的敏感度,笔者将在本文中阐述如何将轴向偏振激发的扫描式等离子显微镜应用于免疫检测上。目前现行的标准蛋白质检测技术为抗原抗体免疫反应,较常见的检测方式为二维平面检测法(Planar Assays)[31],主要是将抗体平面固定化于96或384微孔盘(Microplate)以检测抗原并进行呈色分析,称为酵素连接免疫吸附分析法(Enzyme-linked Immunosorbent Assay,ELISA)。随着基因体研究与基因检测芯片蓬勃发展,蛋白质体学以及多种蛋白质平行化检测技术也逐渐受到重视,在过去传统的酵素免疫分析检测技术,若是针对多种蛋白质同时检测,可于微孔盘上固定化不同的抗体以检测不同的抗原[32],然而能检测的蛋白质种类除了受限于微孔盘本身大小,需要消耗大量的昂贵检测试剂、病患检测样本以及检测时间,加上操作上较为不便,而不太适用于多功检测。因此,MacBeath[33]于2000年提出以自动化蛋白质微阵列点片机(Protein Microarray),将抗体固定化的面积缩小至微米等级,并将多种抗体点于芯片上,以点阵列达到平行化检测与多功的目的。随着近年纳米技术的进步,各种纳米阵列编程技术也逐渐应用在纳米等级生物分子检测的相关研究上[34],借由将蛋白质检测尺度降至纳米等级,不但可以达到蛋白质多功阵列检测的目的,且可以节省昂贵的检测试剂以降低检测芯片制程的成本,除此之外病患的检测样本以及检测时间皆亦可降低其纳米编程技术。例如Piner等[35]于1999年以沾笔式纳米显微术(Dip-pen Nanolithography,DPN)发展出可制作任意纳米点大小与点间距的纳米阵列芯片(Nanoarray),并于2002年时提出了纳米级的蛋白质阵列[36]。此外Deckman于1982提出了纳米球微影术,可以用较低成本的纳米球以自然排列的方式作为掩码而制作出大面积的纳米阵列结构[37]。
2.1 扫描式表面等离子共振显微镜系统
2.1.1 系统建立
笔者利用液晶式轴向偏振器(ARCoptix Liquid-crystal Based Modulator, Radial Polarizer)使波长为780 nm的雷射光(Tsunami Ultrafast Lasers)为轴向偏振,于入射光填满后孔镜的条件下,焦点的最大入射角可由NA=nsin(θ)推算,本方案所使用的60倍油镜(Olympus PlanApo 60X oil objective,NA=1.4)物镜其最大入射角为67.5°。笔者透过CMOS(Mightex Buffered USB2.0 CMOS Camera)收取焦点的傅里叶影像。傅里叶影像黑色圆环半径可表示为表面等离子共振的共振角。
为了能重建出二维的表面等离子体共振图像(SPR Image),笔者透过LabVIEW程序同步控制最小步进为100 nm的二维扫描平台与CMOS的图像撷取,并将所取得的傅立叶平面图像透过子程序NI Vision assistant图像处理软件,计算位于此聚焦点上的表面等离子共振角的角度,以100 ms/step的扫描速率重建出二维的表面电共振图像,其所撰写的LabVIEW程序界面见图2。
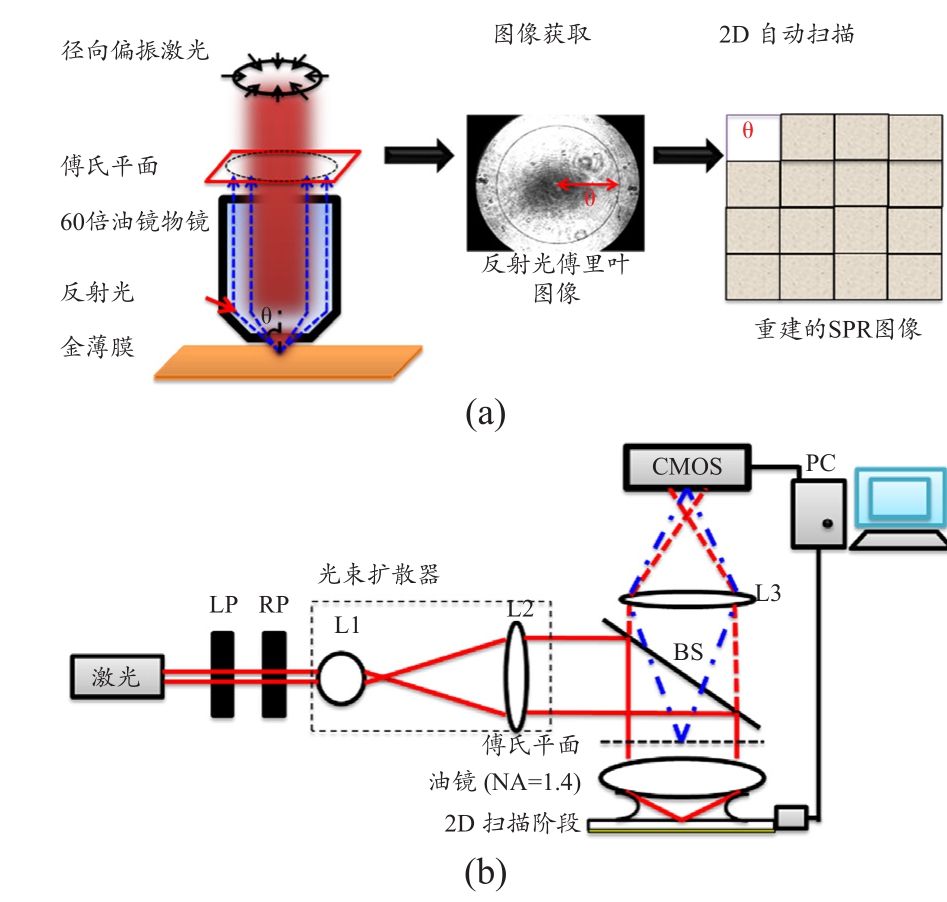
图1 扫描式表面等离子共振显微镜成像原理与光路搭建方式[38]
注:(a)为显微镜成像原理;(b)为光路搭建方式。
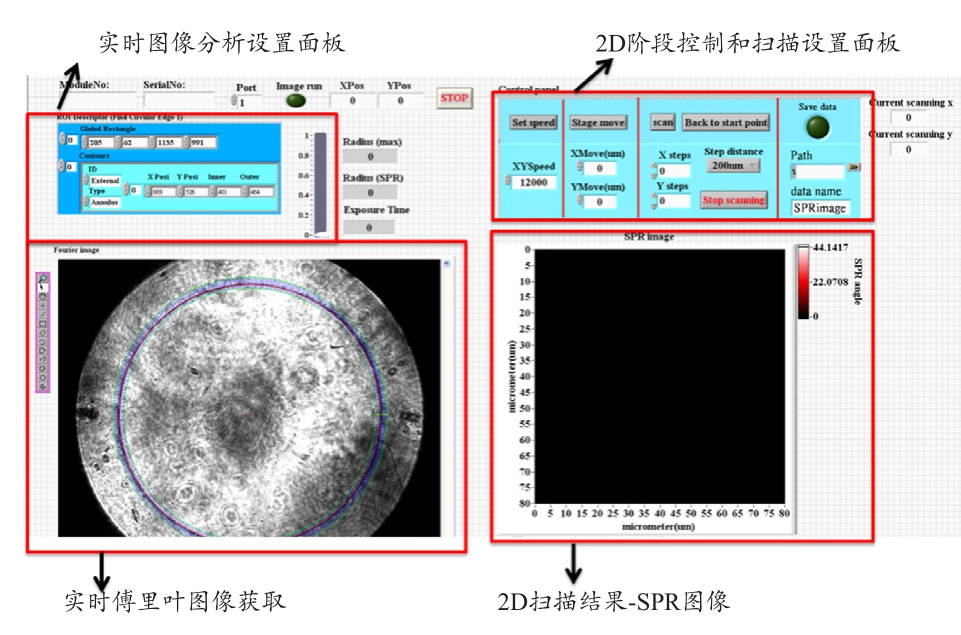
图2 撰写的扫描式表面等离子共振显微镜系统LabVIEW程序操作界面
2.1.2 扫描式表面等离子共振图像的空间解析度量测
透过沾笔式纳米显微术制作出直径800 nm不等间距的纳米金盘对,并将重建的表面等离子共振角图像与扫描式电子显微镜图像的图像截面进行比较分析,其结果见图3。结果表面等离子共振显微术可针对800 nm的结构大小进行造影,其结构间距结果与电子显微术相符,且对于结构心对心距离可解析至1.6 μm以下。
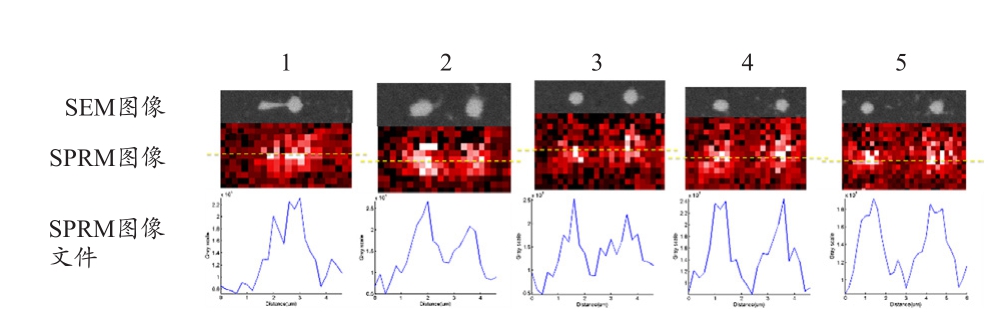
图3 扫描式表面等离子共振显微镜于不同间距的金微纳米结构造影分析与扫描式电子显微镜图像[38]
2.1.3 扫描式表面等离子共振影像的共振角解析度测量
本实验采用不同厚度的氧化锌膜进行共振角解析度测量,其厚度再经由高解析扫描式电子显微镜断面进行确认。不同厚度的氧化锌层的平均共振角和标准偏差分析结果见图4。此系统于低薄膜厚度测量的系统误差,约为10-4的等效折射率变动。其共振角随厚度变化趋势与Macleod商用模拟软件模拟结果也相当一致。此模拟所使用的参数为光波长780 nm、金介电常数为-24.6005+1.7545i、空气折射率1.001、氧化锌折射率1.96、玻璃折射率1.511。
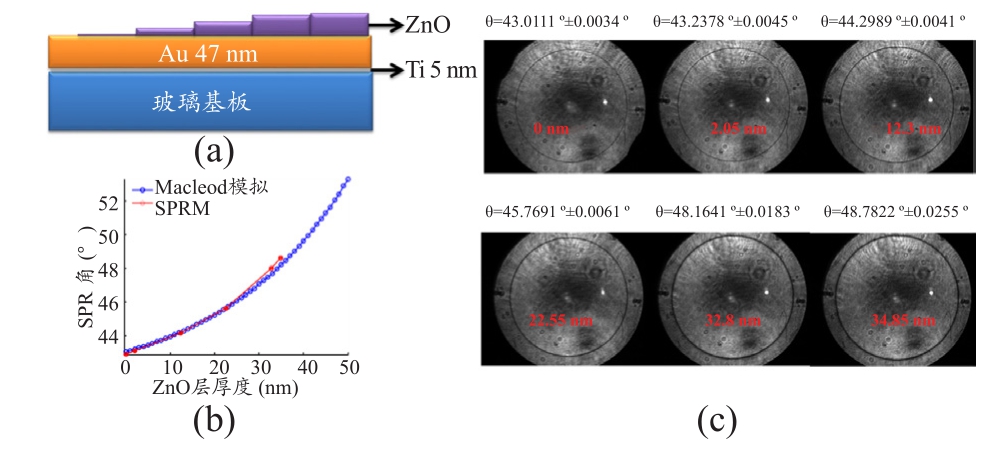
图4 不同厚度的氧化锌层的平均共振角和标准偏差分析[38]
注:(a) 不同氧化锌厚度于金膜上的结构示意图;(b) 不同氧化锌厚度的傅立叶平面图像与扫描10 μm2图像大小后的分析结果;(c) 不同氧化锌厚度的表面等离子共振图像分析结果与厚度模拟的理论模型比较。
2.1.4 微纳米级表面等离子共振的阵列影像
为了解扫描式表面等离子显微术于纳米数组芯片的造影能力,本研究透过沾笔式纳米显微术以及微米球微影制程技术制作直径为800 nm间距3 μm的金微纳米点阵列结构,以及六角形排列的1 μm直径金结构。并扫描此二结构的共振角影响。图5为数组结构的表面等离子共振角图像与扫描式电子显微镜图像对照。
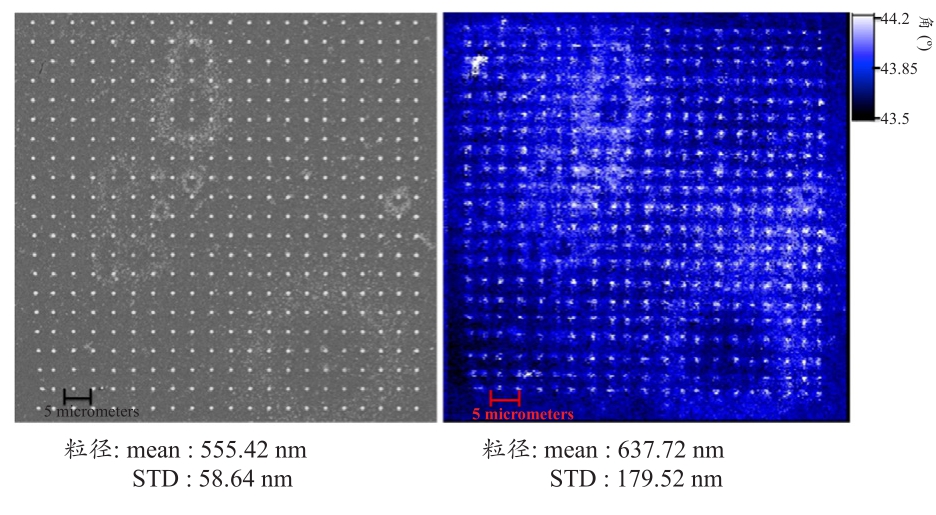
图5 沾笔式纳米制程结构与微米球微影制程结构的扫描式表面等离子共振图像与电子显微镜影像[38]
2.2 等离子显微技术应用于PlGF纳米阵列检测芯片
在确认扫描式表面等离子显微术于纳米阵列造影的能力后,笔者将其应用在PlGF的感测上,并比较平面及纳米结构等两种芯片的感测效果。
2.2.1 平面金膜的定性测量
此部分以传统表面等离子共振检测所使用的平面金膜芯片进行该实验,透过抗原抗体反应进行PlGF的检测,并比较每一阶段蛋白质固定化后的表面等离子共振角度的变化。笔者于金膜表面以十六硫基羧酸(MHA)进行自组装单层修饰,并以6-巯基己醇溶液(MCH)填补降低非特异性吸附,之后同样透过EDC/NHS催化,再固定Protein G于其上,并依序接上胎盘生长因子的抗体与抗原,其蛋白质固定化于金膜表面的流程示意图见图6。笔者将各步骤的表面等离子共振图像做整体正规化,可见随着所修饰的生物分子逐渐增加导致等效折射率的增加,使得表面等离子共振角度的增加。
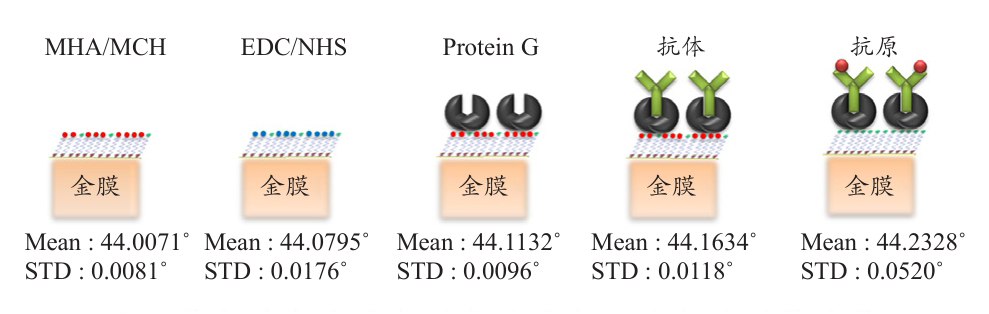
图6 蛋白质在平面金膜表面固定化的定性测量结果
2.2.2 扫描式表面等离子共振显微镜应用于胎盘生长因子的定量检测
金微纳米阵列芯片检测以及平面金膜芯片检测的校正曲线(Calibration Curve)结果如图七所示,将表面等离子共振角变化量与已知抗原浓度做图,蓝色标记为金微纳米阵列芯片检测,而红色标记为平面金膜芯片检测结果。标准抗原浓度配置方法金微纳米阵列检测芯片所使用的标准抗原浓度分别为0、10、25、50、75、100、250、500、1000、2000 pg/mL,而平面金膜检测芯片所使用的抗原浓度分别为0、250、500、1000、2000 pg/mL。从传统的平面金膜检测结果来看,随着胎盘生长因子的浓度增加,表面等离子共振角变化量(SPR Angle Shift)呈现线性的增加趋势;而金微纳米阵列芯片检测结果显示,表面等离子共振角变化量针对浓度250 pg/mL以下的胎盘生长因子呈现高敏感变化的线性趋势。将抗原浓度100 pg/mL以下的金微纳米阵列检测做线性回归,并与抗原浓度2000 pg/mL以下的平面金膜检测的线性回归比较,两组实验的校正曲线的线性回归值皆为0.99左右,而金微纳米阵列的校正曲线斜率为平面金膜10倍左右,并且其检测范围涵盖了胎盘生长因子以低浓度20.6 pg/mL作为阀值的预后诊断标准。由于金结构提供了额外的等效折射率,而使得当抗原接上抗体时,增强了表面等离子共振角的变化量,因此在较低浓度检测时,金微纳米阵列不仅具备线性趋势,其共振角随浓度变化相较于传统金膜检测高,但由于金微纳米阵列可反应的接触面积较少,其线性检测范围也受到限制。此实验不仅证实了扫描式表面等离子显微术及纳米级数组芯片于低浓度肿瘤标记检测上的优势,同时以微纳米等级的检测方式可以用减少样本和检测试剂使用量,并搭配表面等离子共振角检测技术免去第二抗体及呈色步骤,减少检测成本与时间,未来还可利用数组多功检测的优势,进行多种的大肠癌肿瘤标志物数组检测(图7)。
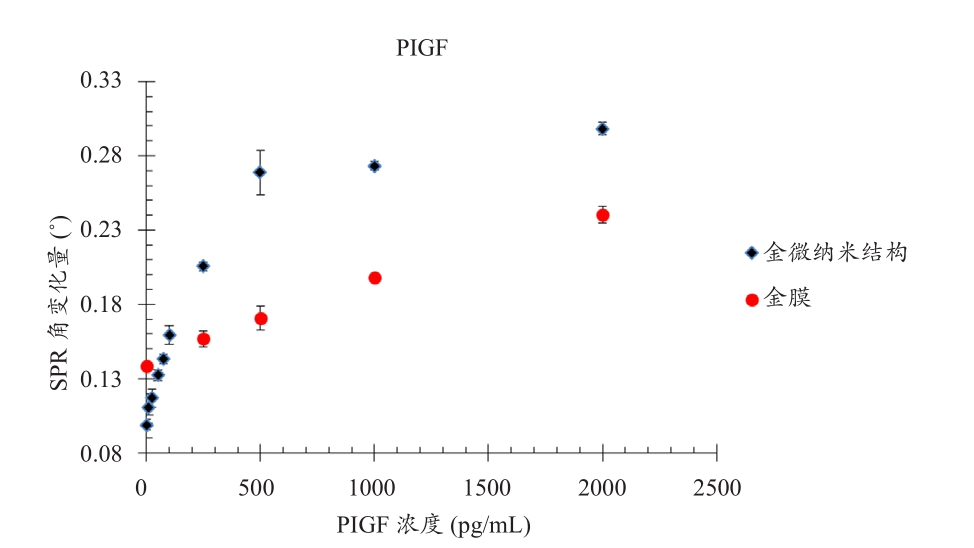
图7 金微纳米结构与平面金膜在不同浓度的胎盘生长因子测量结果
2.3 非对称恒温复制于Kras基因变异的检测
除了癌症转移的监控外,针对肿瘤的治疗药物选择也是至关重要。KRAS基因在现今的大肠直肠肿瘤靶向治疗上扮演了决定性的角色,但由于在样本中突变株KRAS基因数量往往少于原生株KRAS基因数量,因此需要高敏感度的检测方式。本研究结合高敏感度的核酸检测技术和表面等离子共振感测仪,试图提供更灵敏的KRAS检测方案。
首先,笔者发展出了一高敏感度PNA Clamp SMAP-2 Assay,可以透过一次实验准确并快速的检测所有KRAS 12和13密码位突变。特殊的修饰分子如胜肽核酸(Peptide Nucleic Acid,PNA)已经被证实可以提高PCR反应的专一性[39].胜肽核酸是利用长链(2-aminoethyl)-glycine聚合物取代一般核酸的磷酸双酯键骨干。由于PNA无法被聚合酶识别,因此其无法作为聚合反应的起始子,同时也不会被外切酶所分解。此外,由于不具有带电磷酸根,PNA/DNA结合能力比一般DNA/DNA的结合更为强烈,同时其双股溶解温度比同长度的DNA-DNA双股更高,因此对于单核酸突变的敏感度也更高,可以达到10~18 ℃的变化[40-41]。基于此原因,笔者在非对称恒温复制的过程中选用PNA作为可能突变点的杂合片段,见图8。此片段可以抑制原生株基因的复制放大,并增加突变株的复制放大。
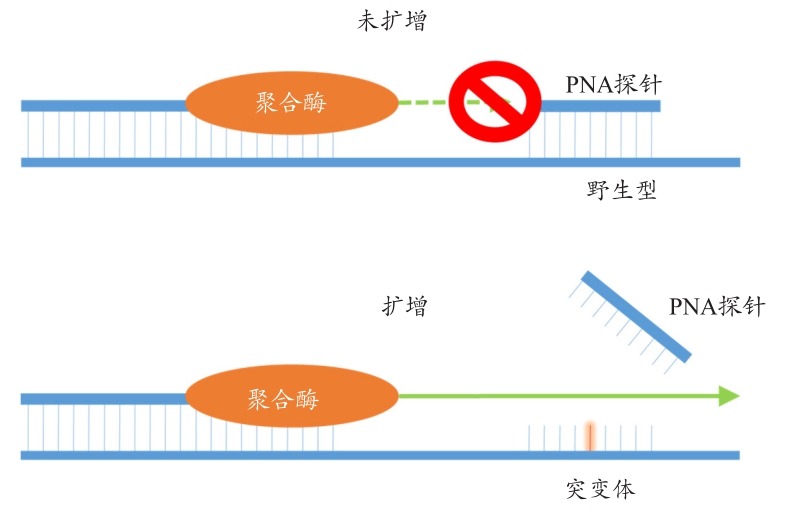
图8 基于肽核酸PNA钳制实时聚合酶链反应
为了验证实验室设计的可行性,在PNA clamp SMAP-2 assay的检测上笔者采用Bio-Rad的real-time PCR cycler,并透过检测SYBR的荧光强度来判别复制反应进行的状况。根据实验结果显示,笔者的实验设计可以在25~35 min内检测出突变株的KRAS基因质体,并且与原生株和负控制组作出区分,见图9。
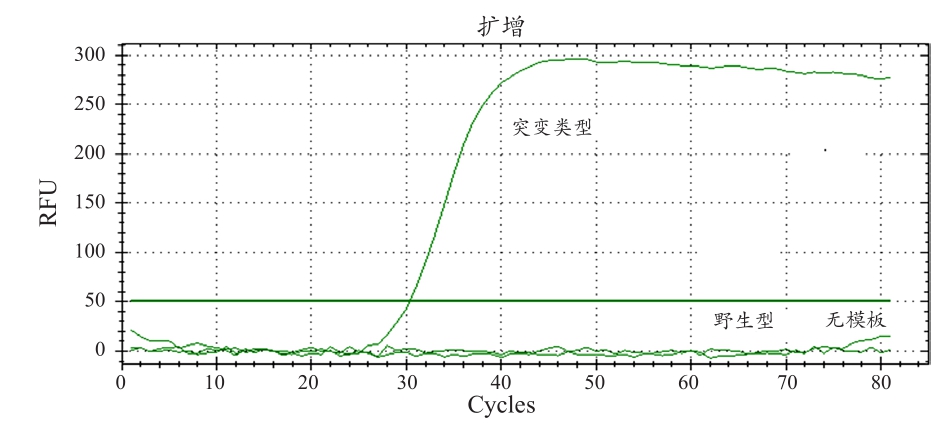
图9 突变株KRAS基因质体的检测试验验证
为了了解本实验设计对于KRAS基因突变检测的敏感度,笔者将样本进行10倍稀释为9种不同浓度后进行同样实验测试,分别如下:1.3×108copies(plot1),1.3×107copies(plot2),1.3×106copies(plot3),1.3×105copies(plot4),1.3×104copies(plot5),1.3×103copies(plot6),1.3×102copies(plot7),1.3×10 copies(plot8),1.3 copies(plot9)。其放大复制结果显示,即使是1.3 copies的低浓度变异株DNA数量,通过笔者的实验室设计可以在40 min左右检测出,展现出此方法的高度敏感性,结果见图10。
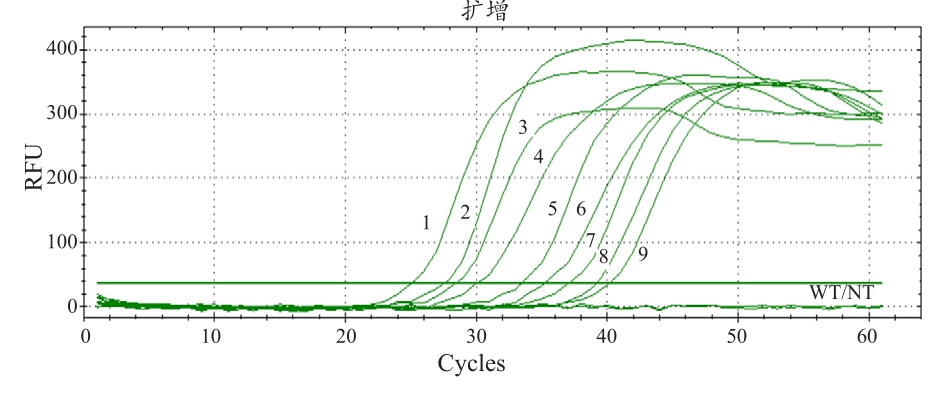
图10 KRAS基因突变敏感度的试验验证
由于KRAS基因突变主要具有7种分型,为了解此方法对于不同突变型的检测能力,笔者也针对7种位于密码区12的突变类型以1.3×108copies的数量进行复制反应测试。根据复制结果显示本研究的实验设计可以全数检测出此7种不同的突变类型,见图11。
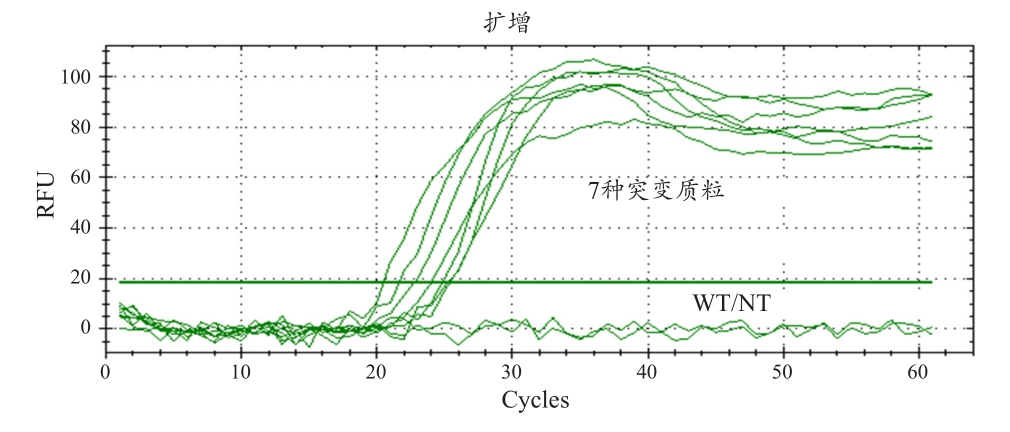
图11 针对7种位于KRAS基因密码区12的突变进行扩增测试
为了达到本研究预计临床即时检测的目的,进一步提高此反应的检测灵敏度,减少其检测所需时间,且达到低成本快速检测等目标。笔者利用表面等离子共振仪对于环境折射率变化的高敏感度,搭配本实验室所量产的可抛式表面等离子芯片进行检测,在无须荧光标记的情况下进行检测,其流程见图12。

图12 红外表面等离子体共振检测芯片的操作流程
实验结果发现,利用红外表面等离子系统搭配可抛式塑料芯片,不只能有效检测出突变株KRAS基因,更可有效缩短复制反应所需的检测时间达10 min以上,其结果见图13。
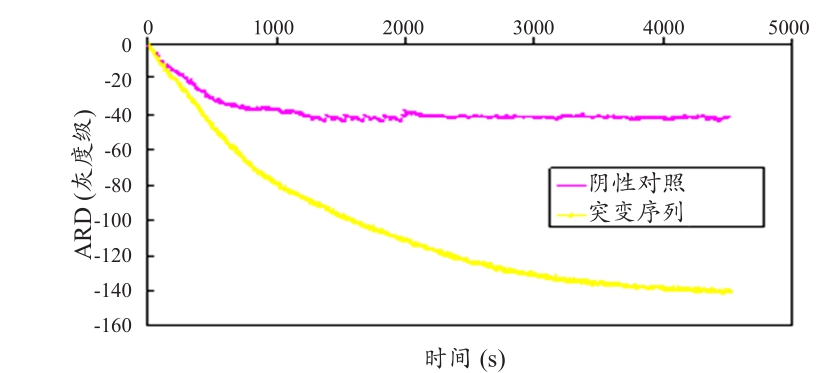
图13 便携式SPR系统SMAP反应的实时SPR检测
注:突变质粒: 1.3×108copies。
3 结论
本研究目的为大肠直肠癌患者提供客制化药物选择的快速肿瘤标记筛检系统及提供临床医生判别大肠直肠癌病人转移风险以协助治疗方式选择判断的检测方案。笔者成功结合轴向偏振雷射光与扫描式等离子显微术,完成具次微米解析力的等离子显微系统。透过金纳米结构的验证,其对于两纳米结构边缘距离及单颗纳米粒子的解析能力可达800 nm,而经薄膜层厚度测试后,可知本系统对于折射率变化的解析力可达10-4等效折射率变动。笔者将此系统应用于大肠直肠癌重要的转移标记,胎盘生长因子PlGF的检测上,其结果显示对低于250 pg/mL浓度的PlGF,金阵列式芯片展现了良好的线性检测,并且在此范围具有较平面芯片更好的敏感度。在KRAS基因突变检测方面,笔者设计一针对KRAS基因的PNA clamp SMAP-2 assay,此法经证实可在40 min内判断至1.3 copies的KRAS基因质体。搭配本实验室所开发的便捷式红外线表面等离子系统及聚合塑料芯片,可成功进行突变株KRAS与原生株KRAS基因的鉴别,并缩短检测时间至30 min内。
致谢
本研究的完成要感谢台湾科技部计划(102-2218-E-002-014-MY3),以及国立台湾大学新兴物质与前瞻元件科技研究中心的技术协助。
[参考文献]
[1] Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2] Winawer S,Fletcher R,Rex D,et al.Colorectal cancer screening and surveillance:Clinical guidelines and rationale-Update based on new evidence[J].Gastroenterology,2003,124(2):544-560.
[3] Kahi CJ,Imperiale TF.ACP Journal Club.Flexible sigmoidoscopy screening reduced colorectal cancer incidence and mortality in older adults[J].Ann Intern Med,2012,18,157(6):JC3-3.
[4] Weinberg DS.In the clinic.Colorectal Cancer Screening[J].Ann Intern Med,2008,148(3):ITC2-1-ITC2-16.
[5] Bethesda,M.,SEER Cancer Statistics Factsheets:Colon and Rectum Cancer.National Cancer Institute[EB/OL].http://seer. cancer.gov/statfacts/html/colorect.html.
[6] Siegel R,Naishadham D,Jemal A.Cancer statistics,2013[J].CA Cancer J Clin,63(1):11-30.
[7] Ludwig JA,Weinstein JN.Biomarkers in Cancer Staging, Prognosis and Treatment Selection[J].Nat Rev Cancer,2005, 5(11):845-856.
[8] Newton KF,Newman W,Hill J.Review of biomarkers in colorectal cancer[J].Colorectal Dis,2012,14(1):3-17.
[9] Wei SC,Liang JT,Tsao PN,et al.Preoperative Serum Placenta Growth Factor Level Is a Prognostic Biomarker in Colorectal Cancer[J].Dis Colon Rectum,2009,52(9):1630-1636.
[10] Tan C,Du X.KRAS mutation testing in metastatic colorectal cancer[J].World J Gastroenterol,2012,18(37):5171-5180
[11] Siena S,Sartore-Bianchi A,Di Nicolantonio F,et al.Biomarkers predicting clinical outcome of epidermal growth factor receptor-targeted therapy in metastatic colorectal cancer[J].J Natl Cancer Inst,2009,101(19):1308-1324.
[12] Massarelli E,Varella-Garcia M,Tang X,et al.KRAS mutation is an important predictor of resistance to therapy with epidermal growth factor receptor tyrosine kinase inhibitors in non-smallcell lung cancer[J].Clin Cancer Res,2007,13(10):2890-2896.
[13] Hoshi K,Takakura H,Mitani Y,et al.Rapid detection of epidermal growth factor receptor mutations in lung cancer by the SMart-Amplification Process[J].Clin Cancer Res,2007, 13(17):4974-4983.
[14] Miyano S,Hanazawa K,Kitabatake T,et al.Detecting KRAS mutations in peripheral blood of colorectal cancer patients by peptide nucleic acid clamp PCR[J].Exp Ther Med,2012, 4(5):790-794.
[15] Krypuy M,Newnham GM,Thomas DM,et al.High resolution melting analysis for the rapid and sensitive detection of mutations in clinical samples:KRAS codon 12 and 13 mutations in nonsmall cell lung cancer[J].BMC Cancer,2006,6(1):295.
[16] Guha M,Castellanos-Rizaldos E,Liu P,et al.Differential strand separation at critical temperature:A minimally disruptive enrichment method for low-abundance unknown DNA mutations[J].Nucleic Acids Res,2013,41(3):e50.
[17] Neutens P,Van Dorpe P,De Vlaminck I,et al.Electrical detection of confined gap plasmons in metal-insulator-metal waveguides[J].Nature Photonics,2009,3(5):283-286.
[18] Wang F,Melosh NA.Power-independent wavelength determination by hot carrier collection in metal-insulator-metal devices[J].Nat Commun,2013,4:1711.
[19] Wang F,Melosh NA.Plasmonic energy collection through hot carrier extraction[J].Nano Lett,2011,11(12):5426-5230.
[20] Aigouy L,Lahrech A,Grãsillon S,et al.Polarization effects in apertureless scanning near-field optical microscopy:an experimental study[J].Opt Lett,1999,24(4):187-189.
[21] Su YD,Chiu KC,Chang NS,et al.Study of cell-biosubstrate contacts via surface plasmon polariton phase microscopy[J].Opt Express,2010,18(19):20125-20135.
[22] Wang S,Shan X,Patel U,et al.Label-free imaging,detection,and mass measurement of single viruses by surface plasmon resonance[J].Proc Natl Acad Sci U S A,2010,107(37):16028-16032.
[23] Kano H,Knoll W.A scanning microscope employing localized surface-plasmon-polaritons as a sensing probe[J].Opt Commun, 2000,182(1-3):11-15.
[24] Watanabe K,Horiguchi N,Kano H.Optimized measurement probe of the localized surface plasmon microscope by using radially polarized illumination[J].Appl Opt,2007,46(22):4985-4990.
[25] Zhan Q.Evanescent Bessel beam generation via surface plasmon resonance excitation by a radially polarized beam[J].Opt Lett,2006,31(11):1726-1728.
[26] Terakado G.High-resolution simultaneous microscopy of refractive index and fluorescent intensity distributions by using localized surface plasmons[J].Applied Optics,2013,52 (14):3324-3328.
[27] Berguiga L,Roland T,Monier K,et al.Amplitude and phase images of cellular structures with a scanning surface plasmon microscope[J].Opt Express,2011,19(7):6571-6586.
[28] Moh KJ,Yuan XC,Bu J,et al.Surface plasmon resonance imaging of cell-substrate contacts with radially polarized beams[J].Opt Express,2008,16(25):20734-20741.
[29] Watanabe K,Miyazaki R,Terakado G,et al.High resolution imaging of patterned model biological membranes by localizedsurface plasmon microscopy[J].Appl Opt,2010,49(5):887-891.
[30] Sung CH,Chauvat D,Zyss J,et al.Enhanced detection of fluorescent nanospheres using two-channel radially polarized surface plasmon microscopy[J].Opt Lett,2010,35(17):2873-2875.
[31] Ellington AA,Kullo IJ,Bailey KR,et al.Antibody-based protein multiplex platforms:technical and operational challenges[J].Clin Chem,2010,6(2):186-193.
[32] Kingsmore SF.Multiplexed protein measurement:technologies and applications of protein and antibody arrays[J].Nat Rev Drug Discov,2006.5(4):310-321.
[33] MacBeath G,Schreiber SL.Printing Proteins as Microarrays for High-Throughput Function Determination[J].Science, 2000,289(5485):1760-1763.
[34] Lynch M,Mosher C,Huff J,et al.Functional protein nanoarrays for biomarker profiling[J].Proteomics,2004,4(6):1695-1702.
[35] Piner RD,Zhu J,Xu F,et al."Dip-Pen" Nanolithography[J].Science,1999,283(5402):661-663.
[36] Lee KB,Park SJ,Mirkin CA,et al.Protein Nanoarrays Generated By Dip-Pen Nanolithography[J].Science,2002,295(5560): 1702-1705.
[37] Endo T,Kerman K,Nagatani N,et al.Multiple Label-Free Detection of Antigen-Antibody Reaction Using Localized Surface Plasmon Resonance-Based Core-Shell Structured Nanoparticle Layer Nanochip[J].Anal Chem,2006,78(18): 6465-6475.
[38] Wei SC,Yang PT,Wu TH,et al.Characteristic investigation of scanning surface plasmon microscopy for nucleotide functionalized nanoarray[J].Opt Express,2015,23:20104-20114.
[39] Demers DB,Curry ET,Egholm M,et al.Enhanced PCR amplification of VNTR locus D1S80 using peptide nucleic acid (PNA)[J].Nucleic Acids Res,1995,23(15):3050-3055.
[40] Kyger EM,Krevolin MD,Powell MJ.Detection of the hereditary hemochromatosis gene mutation by real-time fluorescence polymerase chain reaction and peptide nucleic acid clamping[J].Anal Biochem,1998,260(2):142-148.
[41] Tatsumi K,Mitani Y,Watanabe J,et al.Rapid Screening Assay for KRAS Mutations by the Modified Smart Amplification Process[J].J Mol Diagn,2008,10(6):520-526.
Accuracy Detection in Optoelectronic Medicine: Development of A Surface Plasmon Chip for Early Detection of Colorectal Cancer Metastasis
LIN Qiwan1, WEI Shizhong1, ZHAO Xihong2, WEI Shuzhen3, ZHANG Jiazhen1
1.Institute of Biomedical Engineering National Taiwan University, Taipei Taiwan 100, China; 2.School of Chemical Engineering and Pharmacy, Wuhan Institute of Technology, Wuhan Hubei 430205, China; 3.National Taiwan University Hospital, Taipei Taiwan 100, China
Abstract:The aim of this research is to provide a new examination tool for clinicians to estimate the risk of metastasis of colorectal cancer which may affect the therapeutic process. We firstly combined the radially polarized laser and surface plasmon microscope with sub-micrometer resolution for colorectal cancer sensing. The spatial resolution could achieve 800 nm and the refractive index resolution was 10-4. This system could be used in the detection of placental growth factor with concentration lower than 250 pg/mL. This factor had been proved to be an important marker for colorectal cancer metastasis. Besides, we have also designed a surface plasmon chip in sensingKRASgene mutation. A PNA clamp SMAP-2 assay was used with portable surface plasmon sensing system with plastic biochip, which allowed us to successfully identify the mutation type from wild typeKRASgene within 30 min.
Key words:colorectal cancer; placental growth factor;KRAS; surface plasmon resonance
[中图分类号]R197.39
[文献标志码]A
doi:10.3969/j.issn.1674-1633.2016.03.003
[文章编号]1674-1633(2016)03-0012-08
收稿日期:2015-10-30
修回日期:2015-11-29
基金项目:台湾科技部计划(No.102-2218-E-002-014-NY3)。
通讯作者:林启万,教授。