运用空间协方差模型分析高血压对大鼠大脑老化的影响
林岚,张柏雯,付振荣,宾光宇,高宏建,吴水才
北京工业大学 生命科学与生物工程学院,北京 100124
[摘 要]随着老龄人口的增多和生活水平的提高,我国的高血压人数不断增加,由高血压引发的大脑老化已逐渐成为影响健康的重要因素之一。高血压患者的大脑在中年期已经开始受到一定程度的损害,导致其认知能力逐渐衰退。本研究利用空间协方差模型,分别从大鼠青年组、老年组的磁共振显微图像(MRM)中提取大鼠脑老化的特征模式,并将该模式运用到高血压大鼠组。结果显示青年组与高血压组的网络分数存在显著差别。水迷宫测试的结果也显示网络分数与迷宫学习指数成负相关。实验结果证实短期存在的高血压可以加速大脑老化。可以利用高分辨率的大鼠脑MRM图像结合网络分析方法,开展由高血压引起的相关的脑部变化的治疗和预防评估工作。
[关键词]大鼠脑;磁共振显微成像;高血压;协方差模型
0 引言
高血压是一种以动脉血压持续升高为主要临床特征的慢性病症,是最常见的心血管疾病。它是脑卒中、心肌梗塞、心力衰竭及慢性肾病的主要危险因素之一[1]。在我国,高血压存在着患病率高、死亡率高、残疾率高的“三高”现象,却又同时存在着知晓率低、治疗率低、控制率低的“三低”特点。早在2002年全国居民营养和健康状况调查显示,我国成人高血压患病率达到了18.8%,而且在中、老年人群中,有近一半已被确诊为高血压[2-3]。近年来,我国已成为受高血压病症及其后遗症危害最为严重的国家。早期高血压对大脑的认知功能的影响是隐秘的。其患者可能不会意识到自己的已经出现了认知衰退的问题,而把它误认为是大脑的正常老化,但长期、持续的高血压会加速其患者,尤其是中年患者的大脑老化进程。研究发现,高血压患者出现认知障碍的风险比同年龄血压正常的人高出40%[4]。持续的血压较高会导致记忆力、执行功能和信息处理速度衰退等问题的提早发生[5-7]。中年期的血压升高被发现会加速老年期的认知衰退,并且会提高阿尔茨海默病(Alzheimer’s Disease,AD)的患病风险[8]。大量数据表明,高血压对与年龄有关的认知能力也有着显著影响[9]。此外,长期的高血压更是被证实与脑萎缩直接相关。在高血压病人中,与记忆有关的区域(如海马区)萎缩程度更为明显[10-13]。高血压患者的大脑比同龄受试者老了约4.1岁[14],到目前为止,医学界关于降压药物对大脑认知影响的研究,尚没有统一的定论[15-16]。这可能是由于降压药物的治疗主要是针对老年人,而这些老年人的大脑结构可能已经无法修复。所以研究中年期高血压对认知的影响显得尤为重要。总的说来,中年时期的高血压可以作为一种风险指标来预测未来20年的认知衰退和AD的发病率。
高血压常常伴随着诸多同源性疾病的发生。例如,高血压病人很容易同时患上糖尿病或高血脂。高血脂是造成动脉硬化形成和发展的主要因素。动脉硬化使得患者血管弹性差、外周阻力加大,从而加剧了血压的升高。另据临床调查统计,很多高血压病人常伴有糖尿病,而糖尿病也较多的伴有高血压。除了高血压与糖尿病被猜测存在共同的遗传基因之外,对于造成这种现象的主要原因,一方面可能是糖尿病病人的血管对于具有升压作用的血管紧张素的敏感度较高;另一方面是由于糖尿病易引起肾脏损害,而肾脏功能的损害进而引起血压的升高。迄今为止,大多数对高血压对大脑认知能力改变的研究中,并没有考虑到这些同源性疾病所带来的影响。高血压对大脑的伤害究竟主要是由于高血压本身造成的,还是其它因素也起着关键的作用?中、短期的高血压会对大脑造成伤害吗?小动物磁共振显微(MR microscopy,MRM)成像[17]使得我们可以无创、高空间分辨率地成像,非常适合于动物大脑形态及其功能的微小变化研究。在这项研究中,我们通过对大鼠模型的大脑模型进行MRM成像,来探究短期高血压状态是否会加速大脑的老化。
1.1 研究对象与数据获取
采用15只雄性Fischer344大鼠(10只9月龄大鼠和5只24 月龄大鼠), 其中10只9月龄的大鼠被随机平均分配到青年组和高血压组,而5只24月龄的大鼠被分配到老年组。首先在高血压组的大鼠皮下埋置微量渗透泵,持续泵入血管紧张素Ⅱ(Angiotensin II)8周,4周后更换一次渗透泵。血管紧张素Ⅱ的剂量为1.2 mg/kg/d,8周后取出微量渗透泵。
青年组和高血压组在12月龄时接受MRM采集,而老年组的大鼠在24月龄时接受MRM采集。图像采集使用Bruker Biospec 7T/20 cm小动物MRM成像仪(Bruker BioSpin;Ettlingen,Germany)。72 mm内径的线性鸟笼线圈被用于激发,一个四单元相控阵列表面线圈被用于接收。用异氟烷(1%)与氧和空气以1:3的比例对大鼠进行麻醉。将大鼠放置在动物约束系统进行头部固定。首先通过笛卡尔快速自旋回波扫描序列获得128张连续T2加权像。扫描参数为:TR/TE =1500 ms/40 ms,回波链长度8,翻转角=90°,层厚=0.15 mm,体素大小= 0.15 mm×0.15 mm ×0.15 mm,矩阵256×192,FOV为384 mm×288 mm。在MRM扫描前的一周,通过为期4 d的Morris水迷宫测试任务[18-19],用强迫实验大鼠游泳并学习寻找隐藏在水中平台的方法来测试大鼠的运动能力,以及视觉和空间学习能力。
1.2 图像预处理
首先将图像由原始文件格式转换为NIFTI格式,之后将像素体积调整到与人脑MRI相同体积(1 mm3)。由于受RF线圈等因素的影响,伪影是MRI图像不可避免的问题。小动物MRM由于采用高场强进行数据采集,这一问题更为突出。偏差场在MRM图像上呈现出无规律的、渐近的平滑灰度变化。在这里,我们通过对非参数非均匀强度归一化方法进行优化参数设计[20-21],校正了大鼠大脑MRM图像中的灰度不均匀现象。脑组织提取是神经影像学分析的一项重要预处理过程,在此笔者采用一种结合脑模板和自适应阈值的混合方法[22],实现非脑组织如颅骨或头皮脑组织的分离。
1.3 Dartel处理
Dartel处理主要使用SPM8 (Statistical Parametric Mapping,London,UK)软件包[23],运行环境为MATLAB 7.6 (Mathworks,Natick,MA,USA)。利用SPM8软件包所配备的VBM Dartel软件包[24]完成分析。数据处理的基本步骤包括:首先根据通过高维非线性配准建立一个大鼠全脑平均模板[25]。基于MRIcro软件(Smith 2002)手工获取大鼠脑灰质、白质和脑脊液的划分。以4 mm半高全宽高斯核对划分结果进行空间平滑,以平滑结果为先验概率图像,通过统一分割框架[26]迭代分割,直到结果收敛。基于这个先验概率图像,再将所有受试大鼠的MRM图像分割,得到每个被试大鼠的灰质、白质图像和分割参数。运行Dartel软件:首先利用受试大鼠的分割参数,得到严格校准的灰、白质图像。然后将所有受试大鼠图像的平均作为初始模板,进行6次迭代,每次迭代均将所有个体大鼠的图像与前一次的大鼠模板进行配准,产生一系列流动场。将配准后的个体图像再次平均得到新的模板,直到最后生成最优模板。将刚性对齐的灰、白质图像与最优模板进行非线性配准,同时选择进行调制,生成调制后的图像。使用4 mm半高全宽高斯核对图像进行空间平滑。最后得到可用于后续统计分析的平滑、调制后的标准化数据。
1.4 多变量分析
多变量分析被用来确定与大鼠脑老化相关的脑网络特征参数。采用尺度子配置模型(Scaled SubprofileModel,SSM)[26-27]来建模,SSM是一种协方差分析方法,它通过捕获组间和组内差异的主要来源,产生一系列主成分(Principle Components,PCs)的统计方法。主成分线性组合的最佳拟合可以将对大脑老化贡献最大的脑网络特征起到最好的保持作用。分析的步骤如下:① 首先将调制后的标准化数据进行预处理:数据的自然对数变换与均值的去除,消除不同指标间的量纲差异和数量级间的差异;② 主成分分析捕获变化的主要来源,并产生了一系列的PCs;③ 运用Akaike信息判据(Akaike Information Criterion,AIC)法找出最能反映大脑老化的PCs,创建线性组合模式。最后,将提取的大鼠脑老化的特征模式运用在高血压大鼠上,得到其对应的网络分数。
2 结果
由图1(a)可知,在高场强的大鼠MRM上,存在很强的偏差场。由图1(b)可知,通过对N3算法进行参数优化,可以有效地消了MRM图像中存在的偏差场,并且不同脑组织间对比度得也到了加强。
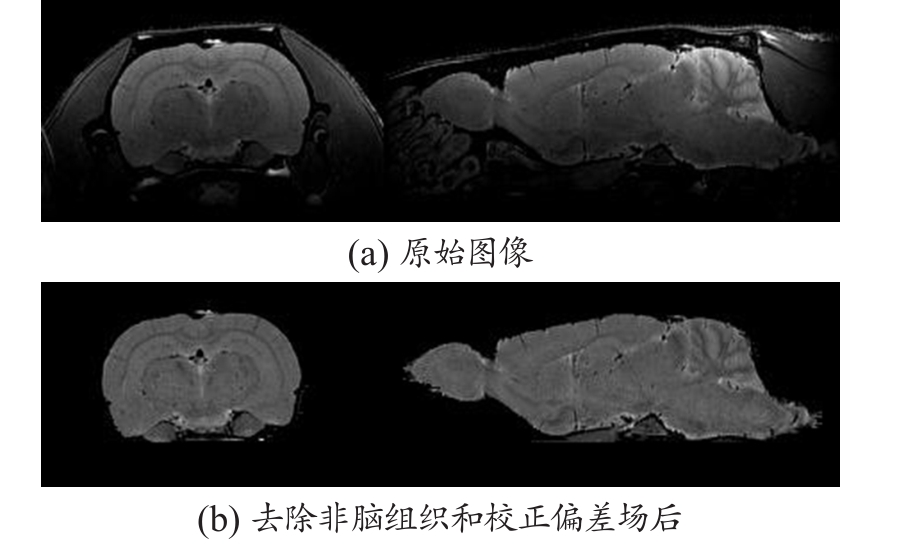
图1 非均匀场校正和非脑组织去除
通过对青年组与老年组PCs的AIC分析确定前两个主成分的线性组合与大脑老化直接相关(R2= 0.876,P<0.001,图2)。这两个主成分可以较好反映大脑老化信息。通过回归模型,可以得到其线性组合。前两个PCs的回归线性组合为大脑老化的特征模式。大鼠大脑的老化模式主要表现为双侧前额叶、边缘皮层和基底神经节部分的脑萎缩以及双侧丘脑和中脑区域脑区的相对增长(图3)。
MRM灰质模式反映了通过SSM取得的前两个主成分的线性组合,在通过500次bootstrap重采样后,Z>4或Z<-4的体素被叠加在MRM图像上。
将大鼠脑老化特征模式应用在高血压组大鼠上时,可以得到高血压组与老化特征相对应的网络分数(图4)。将三组对象的网络分数进行单因素方差分析(One-Way ANOVA),ANOVA结果显示,四组对象的网络分数的平均值存在显著性差异(F(2,14)=36.6,P<0.001)。最小显著差法多重检验结果显示,两组间均存在显著性差异(其中青年组与高血压组两两比较结果为P=0.011)。
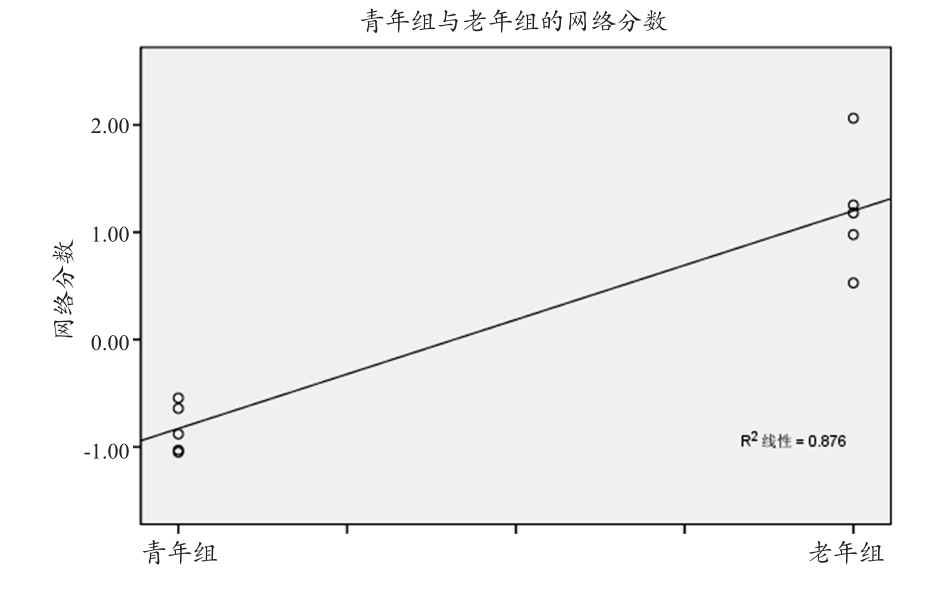
图2 多变量的模式分类分析年龄分组与网络分数间的关系
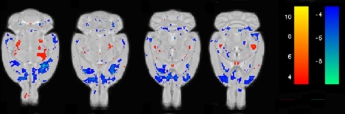
图3 与年龄相关的大鼠脑灰质局部网络特征模式
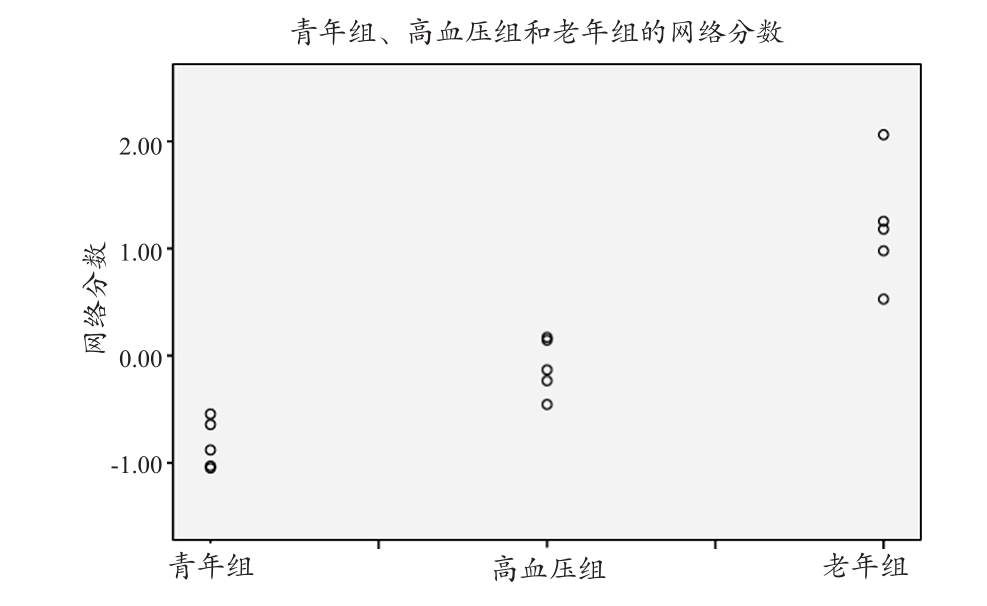
图4 与脑老化模式对应的青年组、老年组和高血压组的网络分数
在Morris水迷宫测试中,计算修正的综合路径长度(Corrected Integrated Path Length,CIPL)[28]。CIPL可以避免结果中引入由于游泳速度和释放位置的差异带来的影响。结果显示网络分数和迷宫学习指数存在着负相关(R2= 0.322,P=0.027,图5)。
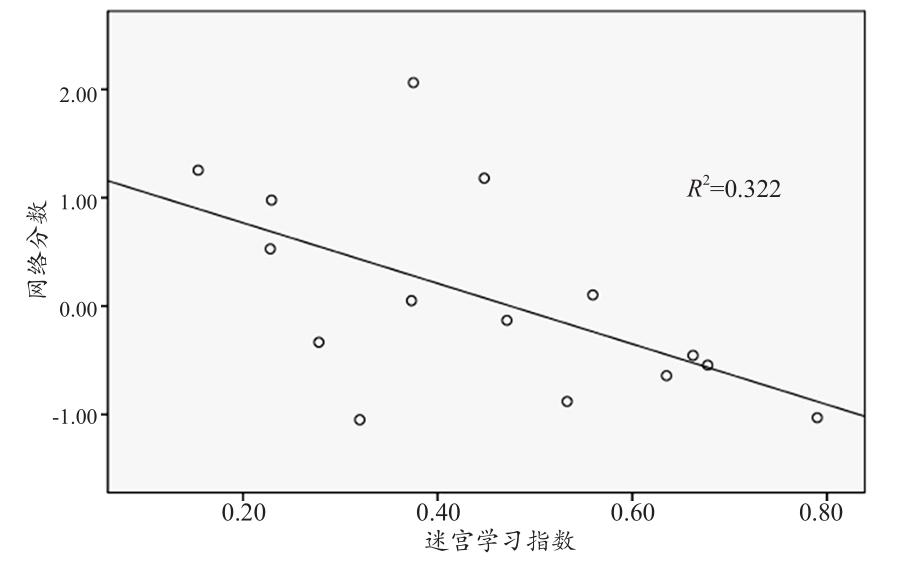
图5 迷宫学习指数和网络分数间的关系
3 讨论
在此研究中,可以通过多变量分析来确定前两个PCs与大鼠老化相关的脑局部网络特征模式。这个特征模式能够将青年组和老年组的大鼠很好的区分(P<0.001)。笔者还发现,尽管青年组与高血压组的大鼠年龄一致,但在与大脑老化相关的网络分数上却存在着显著的差异(P=0.011),这说明短期高血压对大脑的老化进程可以起到非常大的作用。最后,对于这三组实验对象,存在与大脑老化相关的网络分数越高,Morris游泳任务中学习能力越差的现象(P=0.027)。大脑老化的网络分数不仅可以反映大脑的萎缩程度,而且可以在一定程度上反映大脑认知能力的变化。这项研究,可以为识别AD的潜在风险,并为进一步进行相关疾病的干预或治疗提供了重要的依据。总之,基于MRM的多变量网络分析可以帮助深入阐释动物大脑由生理性衰老到病理性衰老的潜在演变过程,并为进一步针对神经退行性疾病的动物模型治疗的研发提供干预手段。
4 结论
本研究当前的实验结果仅是基于15只大鼠进行实验得到的,还属于一个初步的结论。因此,未来还需要对更多大鼠进行测试和比较,来进一步验证并推广这一结果。研究显示,短期的高血压就可以对大脑造成损伤,加速大脑老化。但大脑衰老的速率并不是固定的,而且是可塑的。因此,未来可以进一步研究降压药物对大脑损伤是否存在修复作用。此外,应进一步探讨的是随着大脑老化,脑内功能性联络会出现中断,这就会导致重要激素和自主神经系统反馈环的破坏。而这种整合功能的缺失可能会促进高血压增龄性的生理变化,增加个体对增龄性脑疾病的易感性。因此,在未来的研究中,可以从生理变化整合中枢的角度探索大脑老化和高血压之间的关系。
[参考文献]
[1] Marín J,Rodríguez-Martínez MA.Age-related changes in vascular responses[J].Exp Gerontol,1999,34(4):503-512.
[2] 顾东风,Jiang H,吴锡桂,等.中国成年人高血压患病率、知晓率、治疗和控制状况[J].中华预防医学杂志,2003,37(2):84-100.
[3] 刘力生,王文,姚崇华.中国高血压防治指南[J].中华高血压杂志,2010,18(1):11-30.
[4] Reitz C,Tang M,Manly J,et al.Hypertension and the Risk of Mild Cognitive Impairment[J].Arch Neurol,2007,64(12):1734-1740.
[5] Brady CB,Spiro A 3rd,Gaziano JM.Effects of age and hypertension status on cognition:the Veterans Affairs Normative Aging Study[J].Neuropsychology,2005,19(6):770-777.
[6] Elias MF,Sullivan LM,Elias PK,et al.Left ventricular mass, blood pressure,and lowered cognitive performance in the Framingham offspring[J].Hypertension,2007,49(3):439-445.
[7] Harrington F,Sazby BK,McKeith I G,et al.Cognitive performance in hypertension and normotensives older subjects[J].Hypertension,2000,36:1079-1082.
[8] Wu C,Zhou D,Wen C,et al.Relationship between blood pressure and Alzheimer's disease in Linxian County,China[J].Life Sciences,2003,72(10):1125-1133.
[9] Elias PK,Elias MF,D'Agostino RB,et al.NIDDM and blood pressure as risk factors for poor cognitive performance,The Framingham Study[J].Diabetes Care,1997,20(9):1388-1395.
[10] de Leeuw FE,de Groot JC,Achten E,et al.Prevalence of cerebral white matter lesions in elderly people:a population based magnetic resonance imaging study,The Rotterdam Scan Study[J].J Neurol Neurosurg Psychiatry,2001,70(1):9-14.
[11] Raz N,Rodrigue KM,Acker JD.Hypertension and the brain: vulnerability of the prefrontal regions and executive function[J].Behav Neurosci,2003,117(6):1169-1180.
[12] den Heijer T,Launer LJ,Prins ND,et al.Association between blood pressure,white matter lesions,and atrophy of the medial temporal lobe[J].Neurology,2005,64(2):263-267.
[13] Zalesky A,Fornito A,Harding IH,et al.Whole-brain anatomical networks:does the choice of nodes matter?[J].Neuroimage, 2010,50(3):970-983.
[14] 林岚,张柏雯,付振荣,等.高血压对大脑年龄估值差的影响[J].中国医疗设备,2015,30(6):7-11.
[15] Raz N,Lindenberger U,Rodrigue K M,et al.Regional brain changes in aging healthy adults:general trends,individual differences and modifiers[J].Cereb Cortex,2005,15(11):1676-1689.
[16] Head D,Raz N,Gunning-Dixon F,et al.Age-related differences in the course of cognitive skill acquisition:the role of regional cortical shrinkage and cognitive resources[J].Psychol Aging, 2002,17(1):72-84.
[17] Lin L,Fu Z,Xu X,et al.Mouse Brain Magnetic Resonance Microscopy:Applications in Alzheimer Disease[J].Microsc Res Tech,2015,78(5):416-424.
[18] Morris RG.Developments of a water-maze procedure for studying spatial learning in the rat [J].J Neurosci Meth.1984,11:47-60.
[19] Barnes CA,Danysz W,Parsons CG.Effects of the uncompetitive NMDA receptor antagonist memantine on hippocampal longterm potentiation,short-term exploratory modulation and spatial memory in awake,freely moving rats[J].Eur J Neurosci, 1996,8:565–571.
[20] Sled JG,Zijdenbos AP,Evans AC.A nonparametric methodfor automatic correction of intensity nonuniformity in MRI data[J].IEEE Trans Med Imaging,1998,17(1):87-97.
[21] Lin L,Wu S,Bin G.et al.Intensity inhomogeneity correction using N3 on mouse brain magnetic resonance microscopy[J].J Neuroimaging,2013 23(4):502-507.
[22] Lin L,Wu S,Yang C.A template-based automatic skull-stripping approach for mouse brain MR microscopy[J].Microsc Res Tech,2013,76(1):7-11.
[23] Ashburner J.Computational anatomy with the SPM software[J].Magn Reson Imaging,2009,27(8):1163-1174.
[24] Ashburner J.A fast diffeomorphic image registration algorithm[J].Neuroimage,2007,38(1):95-113.
[25] Lin L,Chen K,John V,et al.MRI Template and Atlas Toolbox for the C57BL/6J Mouse Brain[C].2ndInternational IEEE EMBS Conference on Neural Engineering,2005,6-8.
[26] Ashburner J,Friston KJ.Unified segmentation[J].Neuroimage, 2005,26(3):839-851.
[27] Moeller JR,Strother SC,Sidtis JJ,et al.Scaled subprofile model: a statistical approach to the analysis of functional patterns in positron emission tomographic data[J].J Cereb Blood Flow Metab,1987,7(5):649-658.
[28] 林岚,靳聪,付振荣,等.健康老年人脑年龄预测:基于尺度子配置模型的大脑连接组分析[J].北京工业大学学报,2015,41(6):955-960.
[29] Gallagher M,Burwell R,Burchinal M.Severity of spatial learning impairment in aging:development of a learning index for performance in the Morris water maze[J].Behav Neurosci, 1993,107:618-626.
Application of Spatial Covariance Model in the Analysis of the Impact of Hypertension on Rat Brain Aging
LIN Lan, ZHANG Bai-wen, FU Zhen-rong, BIN Guang-yu, GAO Hong-jian, WU Shui-cai
College of Life Science and Bio-engineering, Beijing University of Technology, Beijing 100124, China
Abstract:With the increase of the aging population and the enhancement of people’s living standards in China, the impact of hypertension (HTN) on the brain aging has become an important health issue. When patients are still in their middle age, HTN has caused a certain degree of damage to the brain. These asymptomatic damage can cause progressively cognitive decline. In the present study, we used spatial covariance model to extract the age-related patterns from the young and old group of rats with magnetic resonance microscopy (MRM). Then we applied this pattern to the rats with HTN. The results showed that the young group and the HTN group had significant difference in network scores, and the network scores were negatively corrected with water maze learning index. Overall, these findings prove that short term HTN may accelerate the brain aging process. The preliminary result supports the using of high resolution rat brain MRM, with network analysis in the evaluation of new treatments for and prevention of the brain changes associated with HTN.
[中图分类号]TP273
[文献标志码]A
doi:10.3969/j.issn.1674-1633.2016.02.008
[文章编号]1674-1633(2016)02-0034-05
收稿日期:2015-09-15
基金项目:北京市自然科学基金(7143171)资助。
通讯作者:林岚,副教授。
Abstract:: rat brain; magnetic resonance microscopy; hypertension; spatial covariance modeling