尤斯灌流室系统应用的研究进展
陈立峰1a,董晗2,郑骏1a,郑天怡1a,宋文锋1b
1.浙江大学医学院附属第一医院 a.医学工程科; b.卫生部多器官联合移植重点实验室,浙江 杭州 310003;2.浙江省医药经济发展中心,浙江 杭州 310003
[摘 要]尤斯灌流室(Ussing Chamber) 由丹麦学者Ussing研究NaCl主动转运时首次介绍于世,其简单实用性使其在生物医学界受到越来越多的关注。Ussing Chamber为研究离子、营养物质、药物在各种上皮组织的转运提供了一个生理系统,其主要是通过微电极来检测整个细胞膜的跨膜电位差、短路电流、跨膜电阻。随着科技的不断进步,Ussing Chamber的用途也越来越广泛。本文结合国内外学者对其研究进行了简单综述,简要介绍其基本结构、原理、应用及未来发展趋势。
[关键词]Ussing Chamber;胃肠道屏障功能;营养运输;药物吸收;胎盘屏障
引言
随着丹麦学者Hans H. Ussing将尤斯灌流室(Ussing Chamber)引入科学研究以来,这项技术受到越来越多的关注,随着技术的不断改进,其应用也越来越广泛,由最初的研究离子的主动转运已扩展到药学、畜禽营养与生理学研究等各个领域[1-4]。该技术的工作原理主要是通过微电极来检测整个细胞膜的电生理变化情况,从而测量离子、营养物质及药物在各种上皮组织的转运,几乎可以应用于动物体内各种上皮组织,包括生殖道内分泌上皮、外分泌腺体上皮、胃肠道上皮、呼吸道上皮、眼以及脉络膜等,甚至包括培养的上皮细胞的研究[2-3]。本文主要介绍Ussing Chamber的基本构造和应用原理,并在此基础上主要论述Ussing Chamber系统在胃肠道屏障功能、营养物质及药物吸收和转运领域、睫状体房水分泌及体外构建胎盘屏障的研究进展,以及研究过程中存在的问题和可能的解决方案。
1 Ussing Chamber的结构及工作原理
1.1 Ussing Chamber的结构
Ussing Chamber系统(图1)主要由灌流室和电路系统两个部分组成,另外还有配套的组件,其通过电子计算机来处理分析数据结果。根据不同的实验目的,灌流室一般分为2、4、6、8室4种类型。同时又有两种灌流方式可供选择:循环式和持续式。循环式灌流室包括1个U形管道系统和2个半室,管道系统主要用于加热和充入气体(CO2、O2或N2),两个半室中间是一个可嵌合组织样本且可移动的插件。持续式灌流室包括两个溶液贮器,通过聚乙烯管道将溶液引入两个半室,溶液温度由配套加热装置加以调节。电路系统可以测定电流、电压、电阻、阻抗和电容等。配套系统包括恒温水浴箱、5% CO2和95% O2混合气体循环系统和注射器等[4]。
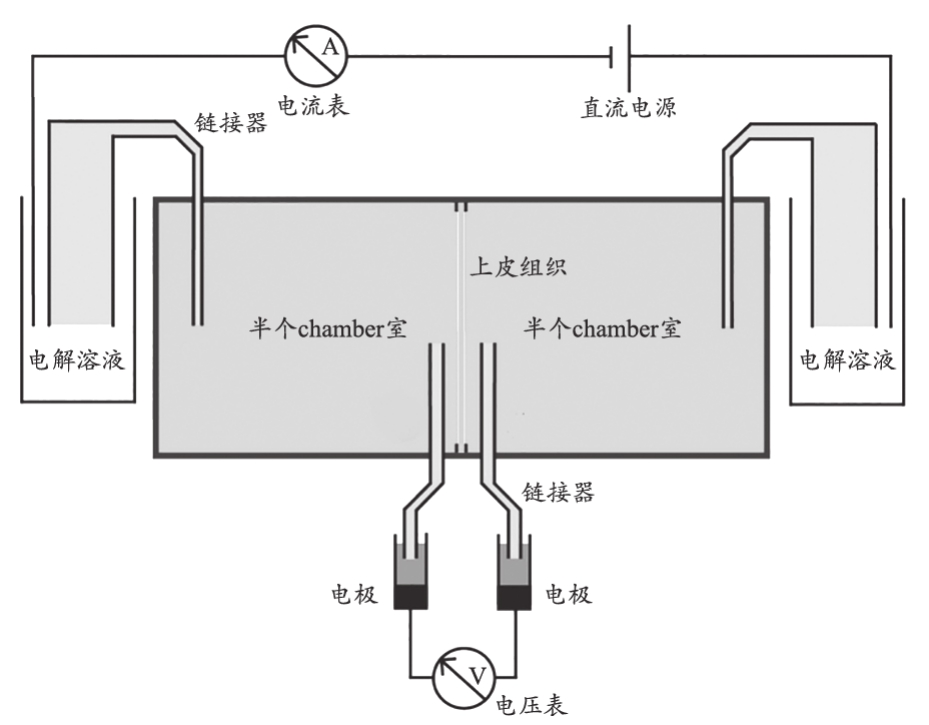
图1 Ussing Chamber基本原理
1.2 Ussing Chamber的应用原理
上皮组织由密集排列的上皮细胞和少量细胞间质组成,具有极性和紧密连接,这也是区别于其他组织的两大特征。紧密连接又称闭锁小带,属于不通透连接,普遍存在于脊椎动物体内各种上皮和内皮细胞,多见于胃肠道上皮细胞之间的连接部位。在相邻的两个细胞有紧密连接的区域,质膜形成索条,索条呈圆筒状,借助特定的蛋白质和二价阳离子,使两个索条紧密并列在一起,从而封闭了细胞之间的间隙,使大分子物质难以通透,而只允许水分子和离子从索条衔接处的小孔透过。
紧密连接的形状和渗透性决定上皮组织的完整性以及对物质的阻抗力(Rt),因此在实际试验中,通常测量Rt来检测或者评价组织完整性以反映组织的活性。上皮组织Rt可用以下公式[5]描述:
其中r为组织电阻系数,L为组织长度或厚度,而A为组织面积。
而对于组织阻抗Rt,在实际操作中,通过电路系统向上皮组织施加一个电压V,相应的会引起电流的变化ΔI,通过欧姆定律就可以得出组织的电阻,这就是所谓的电压钳,如果向上皮组织施加电流则为电流钳。
跨上皮电压(Vt)是测量组织活性的另一个指标,通常认为Vt<4 mV的肠黏膜被认为是活性弱的组织。上皮细胞膜顶侧和基底侧离子的非均匀分布是产生Vt的先决条件。就某一具体上皮组织而言,Vt的计算公式为:
其中Va为细胞膜顶侧电势,Vb为基底侧电势。
短路电流(Isc)是反映组织吸收和分泌离子能力的另一个指标。当试验装置中被测组织短路时,即Vt被钳制为0 mV时,产生的电流即为Isc。这种电流因生物膜上离子流动而产生,故产生的Isc即为穿越上皮组织的主动离子流总和。因此有学者认为单位时间的离子流量能更准确地反映组织活性。
Ussing Chamber系统的基本功能是进行上皮细胞膜离子泵功能和抗渗阻抗的测定。
2 Ussing Chamber的应用
2.1 Ussing Chamber在胃肠道屏障功能中的运用
肠道屏障功能主要是由肠黏膜屏障来实现的。肠黏膜屏障由机械屏障、化学屏障、免疫屏障与生物屏障共同构成,其中最为关键的是机械屏障和免疫屏障。完整的肠道屏障是防止肠道内有害物质和病原体进入机体内环境并维持机体内环境稳定的重要屏障,是机体防御功能的一道重要防线。
机械屏障又称为物理屏障,主要由肠黏膜表面的粘液层、肠上皮细胞及其紧密连接、黏膜下固有层等组成。肠黏膜上皮结构的完整性决定肠黏膜机械屏障功能的健全程度。
化学屏障是肠道分泌的胃酸、胆汁、各种消化酶、溶菌酶、粘多糖、糖蛋白和糖脂等化学物质,也具有屏障作用。
免疫屏障即肠道的免疫防御系统,其主要由肠道相关淋巴组织构成。肠道相关淋巴组织分为组织性淋巴样组织及散在于整个肠壁的淋巴细胞,主要包括PP结、肠黏膜孤立淋巴小结、弥散于肠黏膜的巨噬细胞、T辅助细胞、B细胞、浆细胞和上皮内淋巴细胞等[6]。肠道免疫系统中起核心作用的是分泌性IgA。
生物屏障是动物肠道内存的着多种大量的正常微生物,这些共生的菌群通过与肠黏膜黏附或者结合,形成生物屏障。正常菌群在动物内环境中的定居、繁殖与宿主保持着共生的关系,为宿主提供营养成分,维持肠道微生态平衡[7]。
很多研究者认为Ussing Chamber是研究胃肠道屏障功能的金标准[2,8-9],胃肠屏障功能通常可从离子分泌、渗透性和黏液分泌等3个方面进行评价[2-3,10-12]。用Ussing Chamber对胃肠屏障功能进行的离体研究主要集中在胃肠道上皮通透性、内毒素及细菌移位的途径和机制以及谷氨酰胺(Gln)和益生菌对肠道屏障功能的改善等方面[10];通过检测同位素标记或荧光素标记的大分子物质通过胃肠道上皮的比例已成为研究胃肠道通透性的主要途径。赵博欣等[13]利用体外Ussing Chamber,分别评价50 μmol/L芹菜素及柚皮素经空肠、回肠和结肠黏膜经时吸收方向(M-S)与分泌方向(S-M)的累计透过率和表观渗透系数(Papp),为芹菜素和柚皮素口服制剂的开发以及临床合理用药提供依据。Sun等[14]利用Ussing Chamber研究全肠外营养(Total Parenteral Nutrition,TPN)对大鼠小肠通透性的影响,其试验结果表明TPN将提高大鼠小肠对3H-甘露醇的通透率。TPN增加胃肠道对大分子物质的通透性与胃肠道免疫类物质的下降密切相关。陈红旗等[15]利用Ussing Chamber研究酪酸梭菌二联活菌对结直肠癌患者围手术期的肠道通透性的影响。结果发现,与对照组比较,试验组结直肠黏膜跨上皮电阻无显著升高[(28.3±5.2)Q·c∶(22.1±4.7) Q·c,P=0.1302],结直肠黏膜2 h甘露醇通透率显著降低[(0.91±0.17)%∶(1.65±0.33)%,P<0.001]。该研究表明,结直肠癌患者围手术期应用益生菌制剂(酪酸梭菌二联活菌)能增强肠黏膜屏障功能。宋娟[16]利用Ussing Chamber测定肠道电阻值、荧光素异硫氰酸酯-葡聚糖通透性从而来探讨益生菌和寡糖对热应激肉鸡肠道功能屏障的影响。饶艳霞等[17]利用Ussing Chamber来研究低蛋氨酸饮食对实验性结肠炎大鼠肠粘膜通透性的影响。
2.2 Ussing Chamber在药物吸收研究中的应用
Ussing Chamber技术是目前常用的研究药物胃肠道吸收的体外方法之一。由于在实验操作过程中将离体肠段的浆膜层组织分离,能更有效地模拟药物经肠黏膜吸收方向与分泌方向的双向透过,不仅可以研究药物肠段特定位置的吸收与分泌过程,还能对药物转运的不同阶段进行研究,而且可以模拟胃肠道的生理环境,操作简单快捷[13,18]。其方法是将大小合适的肠片或黏膜固定于互不相通的分别含有黏膜液和浆膜液的槽之间的孔上,孵育一定时间后,测定膜两侧研究药物的量,计算出研究药物从黏膜到浆膜的吸收率[19]。孙亚彬等[20]用该体系评价甘草海藻配伍对大鼠肠黏膜P-糖蛋白(P-gp)的影响。通过对大鼠口服甘草煎液、海藻煎液、甘草海藻合煎液及其合并液、生理盐水一周后,使用Ussing Chamber技术,评价罗丹明123(RHO123)和荧光素钠(CF)经大鼠空肠黏膜的经时吸收方向和分泌方向的透过量和表观渗透系数。RHO123和CF在接受室的浓度用荧光分光光度计检测。结果4种药液均具有增加RHO123经吸收方向透过性的趋势,但仅海藻使RHO123吸收方向的透过性显著增加(P<0.05,与生理盐水组比较)。同时,海藻也使RHO123分泌方向的透过性显著增加(P<0.01,与生理盐水组比较)。但海藻与甘草合用后,合煎组与合并组使RHO123分泌方向的透过性显著减少(P<0.01,与生理盐水组比较);另外,海藻与甘草的单煎液、合煎液、合并液对CF经空肠黏膜转运的吸收方向及分泌方向的透过性与生理盐水比较,均无显著性差异。林玉莲等[21]用该模型研究Labrasol对肠P-gp底物RHO123转运的影响。表明Labrasol有望作为P-gp抑制剂改善受P-gp介导的药物的吸收,提高口服药物的生物利用度。赖乐等[22]用Ussing chamber评价银杏酮酯磷脂复合物体外透过性能研究。张珊珊等[23]用该体系研究左氧氟沙星在胃黏膜体外模型中的转运机制。
2.3 Ussing Chamber在营养物质转运中的应用
Ussing Chamber为研究胃肠道物质转运效率提供了快捷且有效的途径,研究主要集中在葡萄糖、氨基酸以及矿物元素等物质的转运方面[24-35]。葡萄糖经肠道上皮细胞顶膜Na+-葡萄糖-载体蛋白主动转运进入细胞,并由基底膜葡萄糖转运载体转运进入血液。葡萄糖转运过程中Na+跨膜转运产生的离子电流,为Ussing Chamber技术在葡萄糖转运研究中的应用创造了条件,葡萄糖的转运可诱导短路电流的形成,且Isc的产生与Na+依赖型葡萄糖转运载体有关。Garcia-Amado等[36]利用Ussing Chamber技术研究了鹌鹑肠道D-葡萄糖转运,在黏膜侧加入D-葡萄糖,之后加入根皮苷(phloridzin),试验记录Isc,发现D-葡萄糖增加Isc;根皮苷降低Isc,抑制D-葡萄糖转运。氨基酸经肠道上皮细胞顶膜Na+-氨基酸-载体蛋白主动转运进入细胞,Albin等[37]用改良Ussing Chamber研究了胃肠道上皮对谷氨酸、脯氨酸、精氨酸、L-苏氨酸在小肠组织(十二指肠,空肠,回肠)的转运。与葡萄糖的转运类似,脂肪酸的转运也需要脂肪酸转运载体的介导,Kirat等[38]用该系统研究表明,山羊瘤胃中单羧酸转运蛋白1对短链脂肪酸的吸收起着直接的作用。
2.4 Ussing Chamber在眼睫状体上皮离子转运中的应用
睫状体上皮细胞是房水生成的部位,由两层顶端相对的细胞构成,分别是位于房水一侧的非色素上皮细胞(NPE)和位于睫状体基质一侧的色素上皮细胞(PE)。目前人们认为睫状体上皮跨细胞的离子转运是房水主动分泌的动力之一,基质中的溶质(离子)从基质进入色素上皮细胞,然后通过缝隙连接进入非色素上皮细胞,最后被分泌进入房水。而水分子则随着离子的运输被动地进入房水[39]。凌运兰[40]采用改良的Ussing Chamber连续灌注系统电生理检测方法,对新鲜离体的人眼睫状体上皮进行电参数的测量,并应用不同离子浓度液体替代、Na+-K+-ATP酶阻滞剂、Na+-K+-2Cl-协同转运体抑制剂、Cl-通道阻滞剂及缝隙连接阻滞剂等对睫状体血液侧和/或房水侧进行灌注,观察这些药物对人眼睫状体上皮电参数的影响。
2.5 Ussing Chamber在体外胎盘屏障建立中的应用
胎盘屏障是胎盘绒毛组织与子宫血窦间的屏障,胎盘是由母体和胎儿双方的组织构成的,由绒毛膜、绒毛间隙和基蜕膜构成。绒毛膜内含有脐血管分支,从绒毛膜发出很多大小不同的绒毛,这些绒毛分散在母体血之中,并吸收母血中的氧和营养成分,排泄代谢产物。大部分药物透过胎盘的机制仍是被动扩散,但葡萄糖等可按促进扩散的方式转运,一些金属离子如Na+、K+,内源性物质(如氨基酸等),维生素类及代谢抑制剂可按主动转运的方式通过胎盘。Song等[41]用该技术建立了体外胎盘屏障模型。该研究显示β-人绒毛膜促性腺激素(β-hCG)在Ussing Chamber里面的分泌水平是(274.13±13.52)mIU/mL,显著地高于在培养皿中的水平,并且β-hCG在48 h内持续分泌。RHO123的表观渗透系数值从母体测到胎儿侧是(26.34±1.87)nm/s,但是在加入维拉帕米之后增加到(289.55±6.02)nm/s。荧光素的表观渗透系数值是(3.42±0.24)×10-3nm/s。相比之下,异硫氰酸荧光素-葡聚糖的Papp值是(3.93±0.08)×10-5nm/s。这表明在Ussing Chamber里的胎盘片有胎盘的活性,因此是一种有价值的体外胎盘模型。
2.6 Ussing Chamber在其他方面的应用
Ussing Chamber系统的研究对象为上皮组织,而上皮组织广泛分布在身体表面和体内各种囊、管、腔的内表面。上皮组织具有保护、分泌、吸收和排泄等功能,不同部位的不同上皮,其功能各有差异。因此,Ussing Chamber的研究对象可扩展到机体任一上皮组织。就某一具体上皮组织而言,可研究的内容也多样化,从药物筛选到屏障功能、免疫功能、物质吸收与代谢以及分泌和排泄等。Brockmeier等[42]研究了子宫上皮对离子的转运;Lennern?s[43]用该系统预测人类体内口腔药物吸收的情况;Nadine等[44]用该系统研究了视网膜色素上皮细胞的离子转运。
3 讨论Ussing Chamber存在的问题及解决方案
Ussing Chamber的一个主要问题就是用一个相对较少较简单的数据结果去描述较复杂的肠粘膜的生理系统。肠黏膜通过各种方式相互影响。例如,细胞接触、分泌体液因子等,而这些在应用Ussing Chamber进行测量的时候都不会被察觉甚至考虑到[33,45],因此测量结果与体内实际情况还是有很大出入。
其次,从获取肠道上皮到进行Ussing Chamber检测通常需要至少1 h,但是离体的肠道上皮经过一段时间后,因缺乏血液及神经供应,在手术及镶嵌过程中其形态结构容易遭到破坏,因而生物活性不可避免会有所下降[10]。孙志洪等[10]建议,在转运溶液中添加组织活性保鲜剂从而保持或减缓肠道上皮组织形态学和生理活性的下降。有其他学者提出对转运溶液进行肠道上皮生理环境(温度、pH、离子平衡等)的模拟也许能有效解决这一问题[6]。但实际效果还有待进一步研究。
利用Ussing Chamber研究物质转运过程中存在转运溶液渗漏情况,这对实验结果的准确性有很大的影响。Kottra等[46]专门进行过Ussing Chamber边缘渗漏的定量与校正研究,其得出的校正公式具有较好的参考意义。
此外,在实验过程中Ussing Chamber系统通常采用放射性同位素对所研究的物质进行标记。然而,放射性同位素的高昂价格及其种类限制,也使得Ussing Chamber的研究对象受到制约。可以考虑用非同位素物质进行示踪,比如荧光素、探针等[6]。
4 结论
Ussing Chamber是一种首先用于研究离子通道而逐步发展起来的技术。由于它能比较真实地反映各种上皮细胞在体内的实时状态,并且具有简单、快捷的特点,相信随着广大学者对这一技术的关注,Ussing Chamber必将在生物医学领域发挥更重要的作用。
[参考文献]
[1] Ussing HH,Zerahn K.Active transport of sodium as the source of electrical current in the short-circuited isolated frog skin[J]. Acta Physiol Scand,1951,23:110-127.
[2] Clarke LL.A guide to Ussing Chamber studies of mouse intestine[J]. Am J Physiol Gastrointest Liver Physiol,2009,296(6):G1151-G1166.
[3] Le Ferrec E,Chesne C,Artusson P,et al.In Vitro Models of the intestinal barrier[J].Altern Lab Anim,2001,29:649-668.
[4] 杨振,秦环龙.Ussing Chamber在肠道屏障功能研究中的进展[J].肠外与肠内营养,2006,13(4):233-236.
[5] He L,Yin Y,Li T,et al.Use of the Ussing Chamber technique to study nutrient transport by epithelial tissues[J].Front in Biosci,2013,18:1266-1274.
[6] 王建国,韩进诚,王志祥,等.Ussing Chamber技术在家禽肠道营养物质转运研究中的应用[J].中国家禽,2014,36(22):43-46.
[7] Baumgart DC,DignassAU.Intestinal barrier function[J].Curr Opin Clin Nutr Metab Care,2002,5(6):685-694.
[8] Li H,Sheppard DN,Hug MJ.Transepithelial electrical measurements with the Ussing Chamber[J].J Cyst Fibros,2004,3:123-126.
[9] Mardones P,Andrinolo D,Csendes A,et al.Permeability of human jejunal segments to gonyautoxins measured by the Ussing Chamber technique[J].Toxicon,2004,44:521-528.
[10] 孙志洪,贺志雄,张庆丽,等.尤斯灌流系统在动物胃肠道屏障及营养物质转运中的应用[J].动物营养学报,2010,22(3):511-518.
[11] 华永庆,段金廒,钱大玮,等.胃肠道系统功能评价技术体系的建立及其在中药配伍禁忌研究中的应用[J].世界科学技术:中医药现代化,2012,14(3):1553-1561.
[12] Moazed B,Hiebert LM.An in vitro study with an Ussing Chamber showing that unfractionated heparin crosses rat gastric mucosa[J].J Pharmacol Exp Ther,2007,322(1):299-305.
[13] 赵博欣,孙亚彬,段炼,等.应用Ussing Chamber 技术评价芹菜素与柚皮素经大鼠肠黏膜透过特征[J].中国药学杂志,2011,46(20):1581-1586.
[14] Sun XY,Yang H,Nose K,et al.Decline in intestinal mucosal IL-10 expression and decreased intestinal barrier function in a mouse model of total parenteral nutrition[J].Am J Physiol Gastrointest and Liver Physiology,2008,94:G139-G147.
[15] 陈红旗,夏阳,石忱长.益生菌制剂对结直肠癌患者围手术期的影响[J].中华临床营养杂志,2014,22(2):74-81.
[16] 宋娟.益生茵和纤维寡糖对热应激肉鸡肠道功能和氮排放的影响[D].浙江:浙江大学,2014.
[17] 饶艳霞,陈洁,陈蕾蕾,等.低蛋氨酸饮食对实验性结肠炎大鼠紧密连接蛋白表达和功能的影响[J].中华内科杂志,2013, 56(6):503-509.
[18] 祝诚诚,何新.药物肠道吸收研究方法[J].药物评价研究,2010, 33(3):222-227.
[19] Bergmann H,Rogoll D,Scheppach W,et al.The Ussing type chamber model to study the intestinal transport and modulation of specific tight-junction genes using a colonic cell line[J].Mol Nutr Food Res,2009,53(10):1211-1125.
[20] 孙亚彬,李国锋,刘思佳,等.应用Ussing Chamber技术评价甘草与海藻的配伍对大鼠肠黏膜P-gp的影响[J].中国药学杂志, 2010,45(8):585-589.
[21] 林玉莲,蒋学华,杨俊毅.Labrasol对肠P-糖蛋白功能的影响[J].华西药学杂志,2005,20(2):139-142.
[22] 赖乐,莫红缨,赖春丽.体外扩散池法评价银杏酮酯磷脂复合物体外透过性能研究[J].中国药业,2013,22(21):13-15.
[23] 张珊珊,胡咏梅,张磊,等.左氧氟沙星在胃黏膜体外模型中的转运机制研究[J].中国临床药理学杂志,2015,31(1):25-27.
[24] Awati A,Rutherfurd SM,Plugge W,et al.Ussing Chamber results for amino acid absorption of protein hydrolysates in porcine jejunum must be corrected for endogenous protein[J].J Sci Food Agric,2009,89:1857-1861.
[25] Lennern?s H,Nylander S,Ungell AL.Jejunal Permeability: A Comparison between the Ussing Chamber technique and the single-pass perfusion in humans[J].Pharmaceutical Res,1997, 14(5):667-671.
[26] Ewaschuk JB,Murdoch GK,Johnson IR,et al. Glutamine supplementation improves intestinal barrier function in a weaned piglet model of Escherichia coli infection[J].Br J Nutr, 2011,106(6):870-877.
[27] Ducroc R,Sakar Y,Fanjul C,et al.Luminal leptin inhibits L-glutamine transport in rat small intestine:involvement of ASCT2 and B0AT1[J]. Am J Physiol Gastrointest Liver Physiol,2010,299:179-185.
[28] Awati A,Rutherfurd SM,Plugge W,et al.Ussing Chamber results for amino acid absorption of protein hydrolysates in porcine jejunum must be corrected for endogenous protein[J].J Sci Food Agric,2009,89:1857-1861.
[29] Kleberg K,Jensen GM,Christensen DP,et al.Transporter function and cyclic AMP turnover in normal colonic mucosa from patients with and without colorectal neoplasia[J].BMC Gastroenterol,2012,12:78.
[30] Ray EC,Avissar NE,Sax HC.Method used to study intestinal nutrient transport: past and present[J].J Surg Res, 2002,108(1):180-190.
[31] Aschenbach JR,G?bel G.Effect and absorption of histamine in sheep rumen: significance of acidotic epithelial damage[J]. J Anim Sci,2000,78(2):464-470.
[32] Herrmanna J,Schr?dera B,Klingera S,et al.Segmental diversity of electrogenic glucose transport characteristics in the small intestines of weaned pigs[J].Comp Biochem Physiol A Mol Integr Physiol,2012,163(1):161-169.
[33] Ruhnkea I,DeBiasioa JV,Suchodolskia JS,et al.Adapter-modified Ussing Chamber enables evaluation of endoscopically-obtained colonic biopsy samples from cats and dogs[J].Res Vet Sci, 2012,93:1454-1461.
[34] Cehaka A,Wilkensa MR,Guschlbauera M,et al.In vitro studies on intestinal calcium and phosphate transport in horses[J].Comp Biochem Physiol A Mol Integr Physiol,2012,161(2):259-264.
[35] Deachapunya C,Poonyachoti S,Krishnamra N.Sitespecific regulation of ion transport by prolactin in rat colon epithelium[J].Am J Physiol Gastrointest Liver Physiol,2012,302 (10):1199-1206.
[36] Garcia-Amado MA,del Castillo JR,Eglee Perez M,et al.Intestinal D-glucose and L-alanine transport in Japanese Quail (Coturnix coturnix) [J].Poult Sci,2005,84(6):947-950.
[37] Albin DM,Wubben JE,Rowlett JM,et al.Changes in small intestinal nutrient transport and barrier function after lipopolysaccharide exposure in two pig breeds[J].J Anim Sci,2007, 85(10):2517-2523.
[38] Kirat D,Masuoka J,Hayashi H,et al.Monocarboxylate transporter1 (MCT1) plays a direct role in short-chain fatty acids absorption in caprine rumen[J].J Physiolo,2006,576(2):635-647.
[39] 吴仁毅,杨芳,尹金福,等.离体人眼睫状体房水分泌的测定以及药物的影响[J].中国病理生理杂志,2009,25(2):413-416
[40] 凌运兰.应用Ussing-chamber连续灌注系统对人眼睫状体上皮离子转运机制的研究[D].广东:中山大学,2006.
[41] Song D, Guo J,Han F,et al.Establishment of an in vitro model of the human placental barrier by placenta slice culture and Ussing Chamber[J].Biosci Biotechnol Biochem,2013,77(5):1030-1034.
[42] Brockmeier K,Schultheiss G.Regulation of anion transport across the uterine epithelium of Gallus domesticus[J].Poult Sci, 2011,90(3):618-623.
[43] Lennern?s H.Animal data: the contributions of the Ussing Chamber and perfusion systems to predicting human oral drug delivery in vivo[J].Adv Drug Deliv Rev,2007,59(11):1103-1120.
[44] Nadine R,Olaf S.Ion channels and transporters of the retinal pigment epithelium[J].Exp Eye Res,2014,126:27-37.
[45] Tran HT,Tran PH,Lee BJ.New findings on melatonin absorption and alterations by pharmaceutical excipients using the Ussing Chamber technique with mounted rat gastrointestinal segments[J].Int J Pharm,2009,378(1-2):9-16.
[46] Kottra G,Weber G,Fr?mter E.A method to quantify and correct for edge leaks in Ussing Chambers[J].Pflǜgers Arch,1989,415(2):235-240.
Progress in Research on the Application of Ussing Chamber
CHEN Li-feng1a, DONG Han2, ZHENG Jun1a, ZHENG Tian-yi1a, SONG Wen-feng1b
1. a. Department of Medical Engineering; b. Key Laboratory of Combined Multi-Organ Transplantation, the First Aff liated Hospital, School of Medicine, Zhejiang University, Hangzhou Zhejiang 3100032, China; 2. Medicine Economic Development Center of Zhejiang Province, Hangzhou Zhejiang 310003, China
Abstract:The Ussing Chamber was developed by the Danish biologist Ussing as a mean to understand the phenomenon of active NaCl transport, which had attracted more and more attention among the biomedical industry for its simplicity and practicability. The Ussing Chamber provided a physiological system to measure the transport of ions, nutrients and drugs across various epithelial tissues. It measured the trans-epithelial potential, short-circuit current and trans-epithelial resistance of the plasm membrane through microelectrodes. With the progress of science and technology, the Ussing Chamber had become more and more widely applied. This paper reviewed the researches about Ussing Chamber from national and international studies in recent years, and introduced the design, structure, principle, and its application in the field of biomedicine, as well as its application and development trend.
Key words:Ussing chamber; gastrointestinal barrier function; nutrition transport; drug absorption; placental barrier
[中图分类号]R574
[文献标识码]A
doi:10.3969/j.issn.1674-1633.2016.11.018
[文章编号]1674-1633(2016)11-0073-05
收稿日期:2015-11-10
修回日期:2016-01-11