直接心室辅助装置的研究进展与趋势
安大伟,杨明,许自豪,孟凡
上海交通大学 电子信息与电气工程学院 仪器科学与工程系,上海 200240
[摘 要]直接心室辅助装置具有与血非接触的特点,从根本上避免了血液感染、手术大创伤等问题,可用于心肺复苏、心衰辅助等场合,有着重要的临床研究意义。本文通过介绍直接心室辅助装置的生理学意义及国内外研究进展,梳理了直接心室辅助装置目前取得的主要研究成果及存在的问题,为该领域的进一步研究提供了参考依据。
[关键词]直接心室辅助;与血非接触;心衰
0 前言
心血管疾病通常会导致心脏泵血功能下降及充血性心力衰竭。据2014年公布的数据表明,在美国每9例死亡证明中有1例提到心力衰竭,由于心力衰竭引起的死亡人数达279000人。同时,每10万人中有235.5人死于心血管疾病,占死亡总人数的31.9%[1]。在中国,心血管疾病的患病率更呈上升趋势,目前全国心血管病患者约2.7亿,心力衰竭患者450万。2013年农村、城市的心血管疾病死亡率分别为293.69/105和259.40/105,高于肿瘤及其他疾病,居各种疾病之首[2]。心血管疾病及其引起的心力衰竭已是威胁人类生命的严重疾病。对于终末期心衰患者,药物治疗仅能暂时缓解心衰症状,并不能延长患者的存活时间;而心脏移植是应对终末期心衰较为成功的治疗手段[3]。然而,心脏供体不足的限制使得心脏移植手术无法得到有效开展。在这种背景下,机械式心辅助装置的研发得到广泛开展并成功应用于临床,为心肌功能恢复及心脏移植的过渡提供了有效的治疗方法。
心室辅助装置可分为与血接触式及非与血接触式[3]。与血接触式心室辅助装置通常为泵类辅助,在手术使用中需要在心尖及主动脉上取孔插管,通过与自然心脏并联以实现维持人体血液循环的功能。该类辅助装置自20世纪70年代开始迅速发展,并应用于临床。然而由于其与血接触的固有特性,使该类辅助装置不可避免的面临着血液破坏、气栓、右心衰竭等一系列难以克服的问题;同时,由于需对心脏取孔插管的手术要求,也使得手术难度及危险性增大,且不利于心肌功能的恢复。
与血非接触式心室辅助装置通过对停搏或衰竭心脏进行柔性挤压来辅助心脏泵血,从而改善或恢复人体血液循环,又称为直接心室辅助装置。直接心室辅助装置采用包裹心脏的方法对心脏施压,有效避免了血液感染,无需在心尖及主动脉上开孔,大大降低了手术难度及对患者的手术创伤。
1 直接心室辅助的生理学意义
心脏在直接心室辅助装置的包裹下,心脏输出量及泵血能力随着外力对心外膜的同步挤压而提升,通常用收缩末期压力容积关系曲线(ESPVR)的斜率表示[4]。心衰时ESPVR的斜率较正常心脏小,心室收缩能力减弱,如图1(a)所示。在直接心室辅助装置的同步辅助下,ESPVR的斜率增大,心室收缩能力增强,如图1(b)所示。同时,辅助后的压力-容积环较辅助前位置左移、面积增大,血液动力学指标得到明显改善。
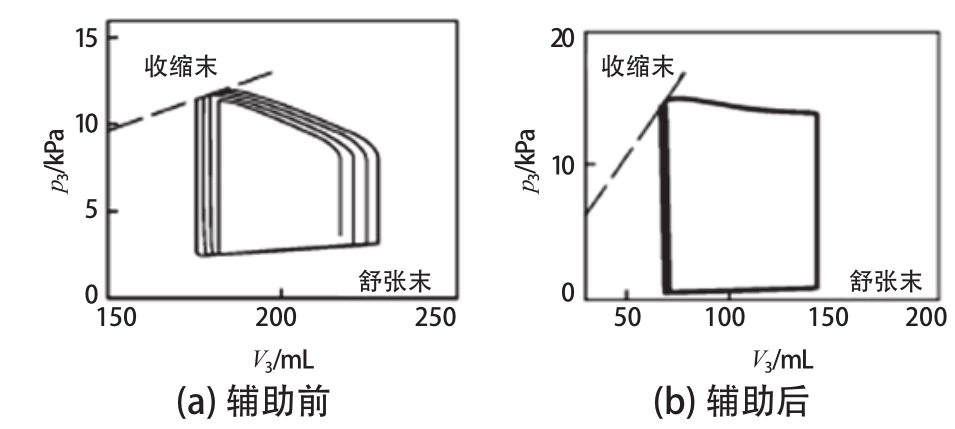
图1 压力-容积环
在心室容积不变的情况下,心室收缩的强度也可通过心室压力来表征。辅助后的心室压力等于心肌收缩压力与施加在心外膜上的压力之和[5]。即:
其中,Pic表示心室内压力,Ptm表示心室跨壁压,PDCC表示直接心室辅助装置对心外膜施加的压力。
2 国外研究进展
直接心室辅助装置产生于20世纪50年代,Bencini等[6]首次尝试利用机械挤压方法辅助心脏泵血。利用心包无弹性的特点,将导管引入心包腔,通过间歇性地挤压与导管另一端连接的气囊来提高心脏的射血能力。然而这种方法会使心房同时受到挤压。经过半个多世纪的发展,研究者对不同结构、不同驱动方式、不同辅助方式的直接机械性心室致动装置进行了研究与探索。
2.1 结构形式
直接心室辅助装置的结构主要分为杯状、袖口状及带状。1965年,Anstadt等[7]设计了用于心肺复苏术的杯状心外膜挤压装置。其外壳为半刚性材料,内层为硅胶隔膜,其上端套于房室沟处以避免装置对心房的挤压。在内、外层中间区域引出导管连接气压驱动设备来辅助心脏收缩和舒张。经过广泛的实验研究,1989年Anstadt辅助杯被批准应用于临床。其第一例病人采用辅助杯进行了56 h的心脏移植过渡且无并发症,在移植后的一年跟踪随访中,病人生存状态良好[8]。
CardioSupport System[9]是一种被设计为袖口状的直接心室辅助装置。其袖口状可膨胀部件围绕在心尖至房室沟之间的部位,可以避免对心尖的挤压。装置通过在心尖位置处施加抽吸负压使袖口紧贴在心脏表面,同时在袖口下端至心尖之间设计有纵肋以防止袖口膨胀部件的移动。此外,装置内层薄膜上还包括2个电极,可以用于与心脏的心电同步和心脏电复律。其控制器可提供抽真空、充气膨胀、心电监测等功能,提供了心衰辅助及心肺复苏2种模式。在心衰辅助模式下,装置可以跟随心电图同步收缩;在心肺复苏模式下,可以设置不同频率使装置按照所需频率对心室挤压。Williams等[9]对CardioSupport System进行了临床前研究,通过采用冠脉栓塞的方法来构建动物急性心衰模型,实验数据表明CardioSupport System可以明显提高心脏输出量和平均动脉压等血液动力学参数。CardioSupport System进行了7 d动物实验没有发现不良反应。
EHAM[10]是一种带状直接心室辅助装置。其塑胶外壳及聚氨酯薄膜部分连接其驱动部分,通过正负压力的变换来实现对心室的挤压或增加心室充盈。因直接心室挤压有可能影响冠脉循环,该装置可对带状结构进行松紧调整以避免对冠脉血流的影响。通过3 h的健康动物急性实验,验证了EHAM在血液动力学及心肌组织灌注方面的辅助效果。
综合对比以上三种不同结构形式的直接心室辅助装置,其区别见表1。
表1 结构形式对比

2.2 驱动形式
气压驱动及液压驱动是目前直接心室辅助装置的主要驱动形式。Anstadt辅助杯及CardioSupport System均是采用气压致动,而EHAM则是采用了液压驱动。此外,ABIOMED的Heart Booster[11]也是采用液压驱动的一种直接辅助装置,其最大特点是容积放大,即用于薄壁管变形的液体容积较心室博出量要小的多。Heart Booster由圆周方向的一组薄壁管组成,当薄壁管为椭圆形(接近于平面)时,Heart Booster周长变大,此时心室充盈;当液体充满薄壁管时,其变为圆形,此时Heart Booster周长变小挤压心室射血。Heart Booster已经进行了体外实验及小牛动物实验,实验数据表明,该辅助装置可以使平均动脉压得到提升。然而Heart Booster不能与心肌表面良好贴合是该装置仍需解决的问题。
2.3 控制方式
直接心室辅助装置的控制方式分为异步控制及同步控制。直接心室辅助装置产生之初,由于技术的限制,其主要通过异步控制用于心搏停止时的心肺复苏手术。近20年来,同步辅助控制逐步成为主流,通过辅助装置与心电同步,直接心室辅助装置已广泛开展起了同步控制的仿真实验、体外实验及动物实验。
2.4 实验方法
对于一种新设计的直接心室辅助装置,其实验方法通常分为仿真分析、体外模拟循环实验、动物实验。而动物实验又分为健康动物急性实验、急性心衰实验及慢性心衰实验。健康动物急性实验用于初步验证辅助装置对血液动力学参数的影响效果,是初期的动物实验,如EHAM装置所进行的实验。而急性心衰实验是初步验证辅助装置对于心衰心脏辅助效果的一种快速有效的实验方法,其应用最为广泛。Anstadt辅助杯、CardioSupport System及Heart Booster均进行了该类实验,然而该类方法无法验证直接心室辅助装置对慢性心衰的辅助效果。2014年,McConnell等[12]首次应用直接心室辅助装置在慢性心衰模型上进行了2 h的动物实验。实验结果表明,在直接心室辅助装置的支持下,血液动力学参数及心脏输出量得到了安全的辅助效果,在辅助后阶段,左心室的收缩、舒张功能及心脏储备功能均得以提升或保持。
3 国内研究进展
国内对于直接心室辅助装置的研究相对较少。2008年,李世阳等[4]建立了包含直接心室辅助的血液循环系统电网络模型,对健康心脏、心力衰竭和直接心室辅助下的循环系统进行了血液动力学仿真分析。模拟了直接心室辅助装置对心衰心脏的支持效果,为新型直接心室辅助装置的设计、动物实验前的准备工作提供了直观、方便的研究手段。循环系统电网络模型如图2所示。
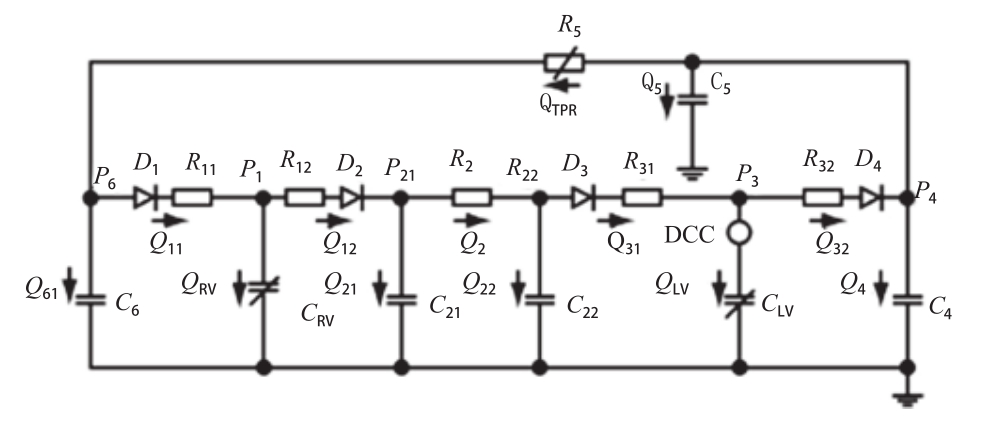
图2 包含直接心室辅助的循环系统电网络模型
2011年,邬顺捷[13]、杨明等[14]设计了一种气动直接心室辅助装置。辅助装置由医用硅胶制成,采用刚性外壳,可以防止气体向外膨胀变形;内膜由2个腔体构成,可以对左右心室选择性挤压,避免两心室承受同等压力,对右心室造成不必要的损伤。其控制程序有标准及外部触发2种模式,在标准模式下,装置会根据设置的辅助频率进行心室辅助,便于体外模拟循环实验;在外部触发模式下,通过外接ECG信号或血压信号控制辅助频率,适用于动物实验等场合。体外模拟循环实验数据显示,应用该装置后主动脉压为94~120 mmHg,主动脉流达5.9 L/min,满足人体循环需求。其结构及模拟循环系统如图3所示。由于其硬质结构的特点,在植入的过程中对胸腔创伤较大,且如何根据心脏大小调节贴合度也是存在的一个问题。

图3 辅助杯和模拟循环系统
注:A为双腔室辅助杯左腔室。
4 展望
直接心室辅助装置遵从与血非接触的设计原则直接对心室进行挤压辅助,有效避免了对血液的破坏,具有仿生学意义。同时,其在手术过程中,无需接入旁路循环系统,手术相对简单易操作,适用于临床急救。然而现有直接心室辅助装置仍然存在有手术切口大、便携性差、控制方式单一、动物实验不充分等问题。因此,在未来的研究中,直接心室辅助装置有以下5个方面亟待重点关注。
(1)柔性化设计:微创是外科手术的发展方向之一,杯状辅助装置采用刚性或半刚性外壳,其外形尺寸固定,手术创伤大,不利于术后恢复;而袖口状、带状的直接心室辅助装置采用柔性化设计,更便于进行微创移植,减小手术对患者的创伤。因此,柔性化设计是直接心室辅助装置结构优化的一个发展方向。
(2)便携式设计:传统直接心室辅助装置多采用气压驱动,然而由于空压机、真空泵体积庞大,使得患者活动范围受限;而采用电动液压驱动的方式则可以大大减小其驱动设备体积,是开展直接心室辅助装置便携式设计的一种可行方案。
(3)生理控制:直接心室辅助装置主要采用异步辅助或同步辅助方式来验证其血液动力学参数的变化。然而随着人工心脏的深入研究,心室辅助装置的辅助水平需要根据循环系统的血液灌注需求进行调整。因此,研究满足血液灌注需求的生理控制策略是直接心室辅助装置下一步研究的重要方向。
(4)动物实验:为验证直接心室辅助装置的辅助效果,多数研究者选择了快速易行的急性心衰模型动物实验;而对于慢性心衰模型动物实验开展较少,这就限制了直接心室辅助装置的应用范围。因此,验证直接心室辅助装置在慢性心衰模型中的中长期动物实验是推进直接心室辅助装置发展的关键环节。
(5)远程监控:研发直接心室辅助装置的远程数据传输及监控系统,可以使心衰患者从院内监护扩展到院外监护,使患者在日常生活中被实时监护、提前预警,从而提高其生存质量。因此,开展直接心室辅助装置的远程医疗系统是适应现代医疗服务发展需求的重要选择。
通过对以上几个方面的关注研究,直接心室辅助装置在心脏移植过渡、心肌功能恢复、临床急救等领域将会有更广阔的发展前景。
[参考文献]
[1] Go AS,Mozaffarian D,Roger VL,et al.Heart Disease and Stroke Statistics-2014 Update:A Report From the American Heart Association[J].Circulation,2014,129(3):e28-e292.
[2] 陈伟伟,高润霖,刘力生,等.《中国心血管病报告2014》概要[J].中国循环杂志,2015,(7):617-622.
[3] 杨明,臧旺福.直接心室辅助致动方法的现状与发展[J].生物医学工程学进展,2008,29(1):37-41.
[4] 李世阳,杨明,李存岑,等.心力衰竭及其在直接心室辅助下的建模仿真研究[J].上海交通大学学报,2008,(5):817-821.
[5] Oz MC,Artrip JH,Burkhoff D.Direct Cardiac Compression Devices[J].J Heart Lung Transpl,2002,21(10):1049-1055.
[6] 李卫民.直接机械性心室辅助[J].实用心脑肺血管病杂志,2002 (2):111-114.
[7] Anstadt GL,Schiff P,Baue AE.Prolonged Circulatory Support by Direct Mechanical Ventricular Assistance[J].Transactions-American Society for Artifi cial Internal Organs,1966,12(1):72-81.
[8] Lowe JE,Anstadt MP.First Successful Bridge to Cardiac Transplantation Using Direct Mechanical Ventricular Actuation[J].Ann Thorac Surg,1991,52(6):1237-1245.
[9] Williams MR,Artrip JH.Direct Cardiac Compression for Cardiogenic Shock With the CardioSupport System[J].Ann Thorac Surg,2001,71(3S):S188-S189.
[10] Wang Q,Yambe T,Shiraishi Y,et al.Non-blood contacting electro-hydraulic artificial myocardium (EHAM) improves the myocardial tissue perfusion[J].Technology and Health Care,2005,13(4):229-234.
[11] Kung RT,Rosenberg M.Heart Booster:A Pericardial Support Device[J].Ann Thorac Surg,1999,68(2):764-767.
[12] Mcconnell PI,Anstadt MP,Del Rio CL,et al.Cardiac Function After Acute Support With Direct Mechanical Ventricular Actuation in Chronic Heart Failure[J].ASAIO J,2014,60(6):701-706.
[13] 邬顺捷,杨明,黄欢,等.一种非血液接触式气动心室辅助装置的设计及体外测试[J].中国医疗器械杂志,2011,(6):398-401.
[14] 廖火根,杨明,庄晓奇,等.心电QRS波检测与心室辅助装置控制系统设计[J].生物医学工程学杂志,2013,(3):617-622.
Research Progress and Prospect of Direct Cardiac Compression Devices
AN Da-wei, YANG Ming, XU Zi-hao, MENG Fan
Department of Instrument Science and Engineering, School of Electronic Information and Electrical Engineering, Shanghai Jiaotong University, Shanghai 200240, China
Abstract:Direct cardiac compression devices can be used to prevent blood stream infection and surgical trauma because the device is non-blood contacting and could be used for cardiopulmonary resuscitation and heart failure support. This paper reviews the physiological signifi cance of direct cardiac compression devices and the research progress on this topic both at home and abroad, also introduces the major achievements and problems existing in current research, and thus provides the reference basis for future research in this fi eld.
Key words:direct cardiac compression; non-blood contacting; heart failure
[中图分类号]TP273
[文献标志码]A
doi:10.3969/j.issn.1674-1633.2016.01.007
[文章编号]1674-1633(2016)01-0031-04
收稿日期:2015-10-17
修回日期:2015-12-21
基金项目:国家自然科学基金(No. 81027001,81571831);上海医疗器械科技支撑项目(No. 14441900500)。
通讯作者:杨明,教授,博士生导师。